 Фибрилляция предсердий – разновидность наджелудочковых тахиаритмий, характеризующаяся некоординированной электрической активностью предсердий, приводящей к ухудшению их сократительной функции. В связи с переходом на МКБ-10 и рекомендациями Европейской ассоциации кардиологии вместо термина “мерцательная аритмия” следует использовать термины “фибрилляция предсердий” и “трепетание предсердий”.
Фибрилляция предсердий – разновидность наджелудочковых тахиаритмий, характеризующаяся некоординированной электрической активностью предсердий, приводящей к ухудшению их сократительной функции. В связи с переходом на МКБ-10 и рекомендациями Европейской ассоциации кардиологии вместо термина “мерцательная аритмия” следует использовать термины “фибрилляция предсердий” и “трепетание предсердий”.
Содержание
Немедикаментозные методы лечения фибрилляции предсердий
Операция Maze в классическом варианте “разрез-шов”
Модифицированная операция Maze с использованием различных способов аблации (Maze IV)
Техника операции с применением монополярной аблации
Техника операции с применением биполярной аблации
Миниинвазивные методики хирургического лечения фибрилляции предсердий
Показания к хирургическому лечению фибрилляции предсердий
Особенности ведения послеоперационного периода
ЭКГ- признаки фибрилляции предсердий: замещение нормальных зубцов Р быстрыми осцилляциями, или волнами фибрилляции (f-волны), различных размеров и формы, связанными с неправильными частыми сокращениями желудочков при ненарушенном АВ-проведении.
ЭКГ- признаки трепетания предсердий: наличие “зубьев пилы” (F-волн), отражающих возбуждение предсердий через равные промежутки времени. F-волны хорошо выражены в II, III, aVF, V1 отведениях, изоэлектрическая линия между зубцами отсутствует.
Классификация фибрилляции предсердий
Пароксизмальная форма – эпизод длиться менее 7 суток (включительно), восстанавливается самостоятельно (чаще в первые 24-48 часов). Если эпизод фибрилляция предсердий купирован при помощи медикаментозной терапии или электрической кардиоверсии до момента ее до момента его спонтанного восстановления (в течение 7 суток), то в этом случае название аритмии не меняется (она продолжает именоваться пароксизмальной).
Персистирующая форма – длится более 7 дней, самостоятельно не восстанавливается, но имеются показания и возможность кардиоверсии. Персистирующая фибрилляция предсердий может быть как первым проявлением аритмии, так и логическим завершением повторных приступов пароксизмальной фибрилляция предсердий.
Постоянная форма – длительно продолжающаяся, когда кардиоверсия противопоказана, не проводилась, или оказалась безуспешной.
Термин “изолированная” фибрилляция предсердий применяется к фибрилляции предсердий, возникающей у людей молодого и среднего возраста (до 60 лет) без клинических и эхокардиографических признаков сердечно-легочного заболевания и не имеющих артериальной гипертензии. С течением времени, в случае развития сердечно-сосудистого заболевания, такие пациенты переходят в общую категорию больных с фибрилляция предсердий.
Термин “идиопатическая” фибрилляция предсердий подразумевает отсутствие четкой причины фибрилляции предсердий, при этом возраст пациента не имеет значения.
Эпидемиология
Фибрилляция предсердий – наиболее часто встречающаяся в клинической практике разновидность тахиаритмии, составляющая примерно 1/3 госпитализаций по поводу нарушений ритма.
Частота распространенности фибрилляции предсердий достигает 2% в общей популяции и 6% у лиц старше 60 лет. У больных с митральным пороком, поступающих для оперативного лечения, фибрилляция предсердий имеет место у 60-80%. Пациенты с ИБС в 6-10% случаев страдают фибрилляцией предсердий. Распространенность с поправкой на возраст больше у мужчин. В последнее время наблюдается значительный рост заболеваемости фибрилляцией предсердий, ожидается увеличение числа пациентов вдвое в течение последующих 20 лет.
Прогноз
Частота развития ишемического инсульта у пациентов с фибрилляцией предсердий неревматической этиологии в среднем 5% в год, что в 5-7 раз выше, чем у людей без фибрилляцией предсердий. Каждый шестой инсульт происходит у больного с фибрилляцией предсердий. У пациентов с ревматическими пороками сердца и фибрилляцией предсердий риск развития инсульта увеличивается в 17 раз по сравнению с контрольной группой аналогичного возраста (по данным Фремингемского кардиологического исследования). Смертность среди пациентов с фибрилляцией предсердий приблизительно в 2 раза выше, чем у больных с синусовым ритмом и взаимосвязана со степенью тяжести основного заболевания.
У пациентов с длительной тахисистолией развивается тахикардиомиопатия, сопровождающаяся дилатацией полостей сердца, снижением фракции выброса, появлением регургитации на атриовентрикулярных клапанах, что приводит к нарастанию сердечной недостаточности. Отсутствие предсердного вклада на фоне нерегулярных сокращений желудочков приводит к снижению сердечного выброса на 20-30%, что особенно выражено при нарушении диастолического наполнения левого желудочка в случае митрального стеноза, диастолической дисфункции левого желудочка.
Наличие фибрилляции предсердий после кардиохирургических вмешательств сопряжено с повышенной летальностью, тромбоэмболическими осложнениями, инвалидизацией и снижением качества жизни пациентов. Хирургическое устранение клапанной патологии даже с использованием в послеоперационном периоде электрической кардиоверсии и антиаритмических препаратов может привести к стойкому восстановлению синусового ритма у данной категории пациентов только в 6-10%. Несмотря на то, что в арсенале кардиолога имеется значительное количество антиаритмических препаратов, фармакологическое лечение фибрилляции предсердий до сих пор представляет значительную проблему. Это связано с недостаточной эффективностью лекарственной терапии, высокой частотой рецидивов и серьезными побочными эффектами препаратов, вплоть до развития фатальных нарушений сердечного ритма и внезапной смерти.
Фибрилляция предсердий представляет большую финансовую проблему для системы здравоохранения, так как стоимость лечения пациентов, страдающих фибрилляцией предсердий, на 35-40% выше, чем у больных той же возрастной группы.
Патофизиологические аспекты и механизмы фибрилляции предсердий
Фибрилляция предсердий – сложная аритмия, патогенез которой до конца не изучен. Большое значение в возникновении и поддержании фибрилляции предсердий придают эктопической фокусной и триггерной активности, механизму множественных повторных кругов возбуждения (re-entry) и автономной нервной системе (ганглионарные плексусы). Чаще всего эктопические фокусы расположены в устьях легочных вен (до 80-90%), реже в crista terminalis, связке Маршалла, устье коронарного синуса, межпредсердной перегородке.
Субстратом для изменения электрофизиологических свойств миокарда предсердий могут служить фиброз, воспаление, ишемия и гипертрофия. В последнем случае даже введен термин “критической” массы фибриллирующего предсердного миокарда. Все эти причины приводят к увеличению дисперсии рефрактерных периодов в различных зонах предсердий и анизотропии проведения возбуждения, что способствует реализации механизма re-entry. Как было доказано J.Cox, круги re-entry чаще всего функционируют вокруг анатомических препятствий гомогенному проведению возбуждения по предсердиям (отверстия полых и легочных вен, коронарного синуса и атриовентрикулярных клапанов). Чем длительнее существует фибрилляция предсердий, тем более выражено электрическое ремоделирование предсердий (укорочение рефрактерного периода), что отражает постулат “фибрилляция предсердий порождает фибрилляцию предсердий”. Схематическое изображение механизма развития фибрилляции предсердий представлено на рисунке.
Немедикаментозные методы лечения фибрилляции предсердий
Профилактическая электрокардиостимуляция у пациентов с синдромом слабости синусового узла
- постоянная предсердная стимуляция
- алгоритмы превентивной стимуляции (непрерывная динамическая овердрайвстимуляция, триггерная овердрайвстимуляция)
- стимуляция межпредсердной перегородки
Катетерная аблация АВ узла (модуляция АВ-проведения деструкцией медленных α-путей, деструкция АВ-узла с имплантацией ЭКС - предпочтительна бивентрикулярная стимуляция)
- показана пациентам с выраженной симптоматикой и рефрактерным к медикаментозной терапии, однако не снижает риск тромбоэмболических осложнений, так как не устраняет фибрилляции предсердий
Эндоваскулярные катетерные методы аблации
- в левом предсердии (фокусная аблация, аблация ганглионарных плексусов, изоляция легочных вен) при пароксизмальной и персистирующей фибрилляция предсердий
- аблация истмуса правого предсердия при трепетание предсердий
Хирургические методы
- классическая операция Maze (лабиринт) в виде “разрез-шов”
- модифицированная операция Maze с применением различных видов аблации (моно- или биполярная радиочастотная, криоаблация, микроволновая, лазерная или с использованием высокоинтенсивного фокусированного ультразвука)
- миниинвазивные вмешательства (мини-Maze) из миниторакотомии (торакоскопии) с применением различных вариантов эпикардиальной аблации.
Операция Maze в классическом варианте "разрез-шов"
Впервые выполнена в клинике J.Cox в 1987 г., претерпела три модификации в руках автора. Оригинальная хирургическая техника процедуры Maze-I и Maze-II была изменена вследствие отрицательного воздействия на синусовый узел, задержку внутрипредсердной проводимости (Maze-I) и чрезвычайной сложности выполнения процедуры (Maze-II).
В настоящее время процедура Mazе-III стала техникой выбора при хирургической коррекции фибрилляции предсердий.
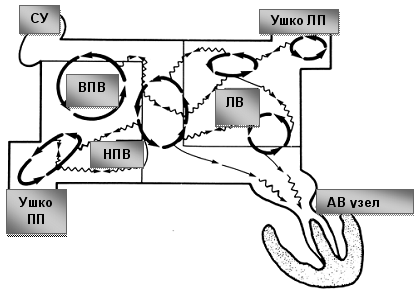
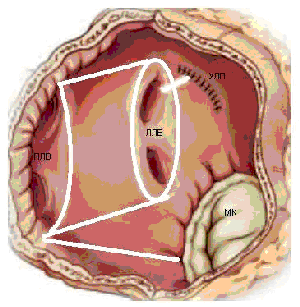
Операция электрофизиологически обоснована и анатомически ориентирована. Основана на теории множественных кругов macro re-entry, формирующихся вокруг анатомических образований: устьев легочных вен (ЛВ) и коронарного синуса (КС), верхней и нижней полых вен (ВПВ и НПВ), ушек левого (УЛП) и правого предсердий (УПП), отверстий атриовентрикулярных клапанов. Операция предполагает изоляцию этих образований и прерывание путей проведения вдоль митрального и трикуспидального клапанов. Хирургические разрезы проводятся таким образом, чтобы электрический импульс, выходя из любой точки предсердия, не мог вернуться в эту же точку без пересечения линии шва (принцип лабиринта). Тем самым обеспечивается один маршрут следования электрического импульса из синусового узла (СУ) к АВ-узлу с многочисленными тупиками по пути, чтобы обеспечить активацию всего миокарда предсердий одновременно.
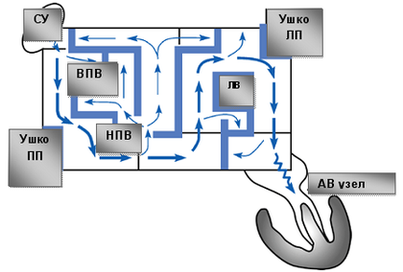
Таким образом, операция Maze сохраняет функцию синусового узла и АВ-соединения, сохраняет организованную синхронизированную электрическую деполяризацию предсердий и желудочков, восстанавливает предсердную транспортную функцию.
Хирургическая техника
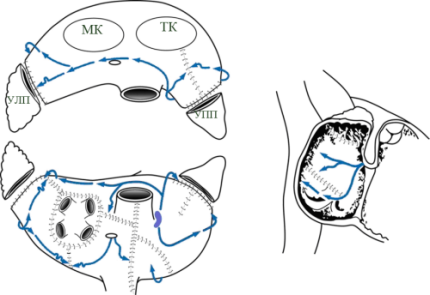
- изоляция легочных вен единым блоком
- удаление ушек обоих предсердий
- соединение разрезом шва ушка левого предсердия с коллектором легочных вен
- соединение разрезом шва ушка правого предсердия с фиброзным кольцом трехстворчатого клапана
- соединение коллектора легочных вен с задней полуокружностью фиброзного кольца митрального клапана
- Т-образный разрез правого предсердия (вертикальная атриотомия от предсердно-желудочковой борозды + продольный разрез между верхней полой веной и нижней полой веной)
- разрез межпредсердной перегородки от атриотомии до коронарного синуса
- атриотомические разрезы соединяются между собой
Модифицированная операция Maze с использованием различных способов аблации (Maze IV)
Несмотря на доказанную эффективность (до 95-97% пациентов не имеют фибрилляции предсердий в отдаленном периоде) операция Maze в классическом исполнении не нашла широкого распространения из-за сложности выполнения, необходимости длительной остановки сердца и искусственного кровообращения. Как следствие, в послеоперационном периоде возникает риск кровотечения и острой сердечной недостаточности. В последние годы большая часть разрезов при проведении операции Maze заменена на использование линейной аблации для создания двунаправленного блока проведения электрического импульса. Для этого предложены: криовоздействие, радиочастотная, микроволновая, лазерная энергии и высокочастотный фокусированный ультразвук.
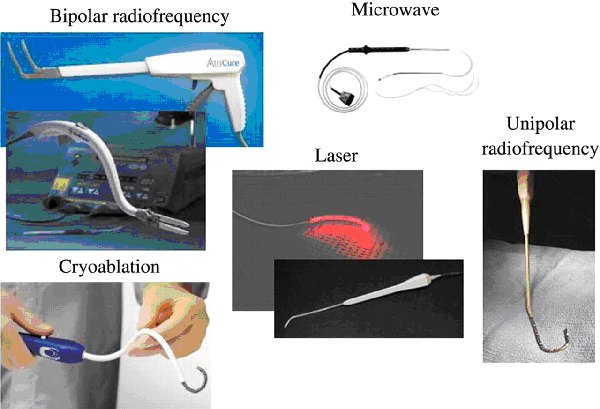
Операция Maze IV значительно проще в исполнении, однако ее эффективность несколько ниже (до 70% при постоянной и до 90% при пароксизмальной форме).
Требования к аблационным устройствам
- возможность создания трансмурального повреждения для полного блока проведения (контроль трансмуральности по температуре, импедансу и т.п.)
- безопасность в отношении окружающих органов и анатомических структур (пищевод, коронарные артерии, коронарный синус)
- низкопрофильность и достаточная гибкость для оптимального позиционирования в полостях сердца
- адаптация к миниинвазивным доступам с возможностью создания трансмурального эпикардиального воздействия
Криовоздействие
- использование жестких многоразовых электродов на основе закиси азота (охлаждение -89,5˚C) или гибких одноразовых на основе аргона (охлаждение до -185,7)
- высокий уровень безопасности и эффективности при эндокардиальном воздействии в условиях ”сухого” сердца
- длительнее, чем другие виды воздействия (аппликация до 2-3 минут)
- на работающем сердце эпикардиальное криовоздействие имеет низкую пенетрирующую способность ввиду согревающего эффекта циркулирующей крови
Радиочастотная аблация (РЧА)
- использование энергии переменного тока в диапазоне от 100 до 1 000 кГц
- моно и биполярный режим воздействия, орошаемая или сухая аблация
- резистивный нагрев тканей возникает только в непосредственной близости от монополярного воздействия (2-3 мм) а более глубокие ткани нагреваются посредством пассивной проводимости, в случае биполярного воздействия ткань нагревается только между двумя электродами без риска воздействия на окружающие ткани
- используются электроды в виде “ручки” с торцевым воздействием или многополюсные полужесткие
- аблация с помощью монополярных электродов является более “хирург-зависимой”, чем биполярная, так как отсутсвует алгоритм достижения трансмуральности, а эффект оценивается визуально
- выполнение аблации вблизи атриовентрикулярных клапанов (исмусы правого предсердия и левого предсердия) биполярным электродом затруднительно
- созданы специальные низкопрофильные гибкие электроды для проведения эпикардиальной радиочастотная аблации из миниинвазивных доступов (миниторакотомия, торакоскопия)
Скачать видео - Полностью эндоскопическая радиочастотная аблация легочных вен (9,54 Мб)
Микроволновая аблация
- основана на излучении электромагнитных волн на частоте 915 МГц или 2450 МГц, вызывающих осцилляцию молекулярных диполей, приводящую к диэлектрическому нагреванию ткани
- существует только в монополярном варианте без алгоритма трансмуральности воздействия, имеется температурный контроль и рекомендуемые программируемые параметры длительности и мощности воздействия
- имеется вариант эпикардиального воздействия из миниинвазивного доступа
Ультразвуковая аблация
- используется высокоинтенсивный фокусированный ультразвук в диапазоне частот от 1 до 5 МГц, эффект основан на явлении ультразвуковой кавитации, приводящей к коагуляционному некрозу тканей
- существует в монополярном варианте только для эпикардиального воздействия
- более эффективна при воздействии на работающем сердце, чем монополярная РЧА, так как менее подвержена охлаждению циркулирующей кровью
- высокая степень безопасности для окружающих тканей, так как воздействие осуществляется в определенном фокусе (т.е. на определенной глубине)
Лазерная аблация
- основана на эффекте фотокоагуляции, длина волны 980 нм лазерного воздействия совмещена в устройстве с видимым красным светом для отражения зоны воздействия
- используются специальные гибкие фиброоптические проводники
- возможность вызывать трансмуральное воздействие доказана в эксперименте, однако отсутствует механизм контроля трансмуральности
- в стадии клинической апробации
Техника операции с применением монополярной аблации
Операция проводится в условиях искусственного кровообращения с нормотермической перфузией с использованием бикавальной канюляции. Чаще используется при необходимости вскрытия предсердий для вмешательства на митральном и трикуспидальном клапанах. Левое предсердие вскрывается параллельно межпредсердной борозде, ушко левого предсердия резецируется с ушиванием его основания или проводится его электрическая изоляция с ушиванием изнутри. Левые легочные вены изолируются одним блоком с прилегающей стенкой левого предсердия и соединяются линией аблации со швом ушка левого предсердия.
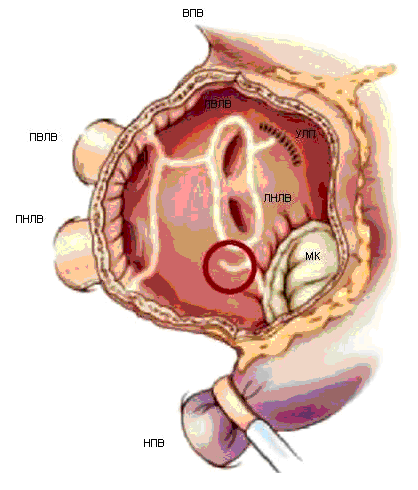
Затем проводится аблация в области левого истмуса соединением аблационной линией левой нижней легочной вены с задней полуокружностью митрального клапана.
Направление аблации следует проводить с учетом типа кровоснабжения сердца при оценке коронарографии. При доминирующей огибающей ветви аблация осуществляется по направлению к сегменту Р3, при выраженном правом типе кровоснабжения по направлению к сегменту Р1, при сбалансированном – к сегменту Р2. Это необходимо учитывать для предотвращения термического повреждения огибающей ветви. Рекомендуется при проведении аблации в этой зоне проводить короткую кардиоплегию с той же целью. Короткая линия аблации проводится также вдоль коронарного синуса (до 2см). Правые легочные вены изолируются одним блоком соединением аблационной линии с разрезом левого предсердия . Изоляции левых и правых легочных вен соединяются между собой в области крыши левого предсердия, так как эта зона более безопасна в отношении пенетрации воздействия на пищевод.
Правое предсердие вскрывается вертикальным разрезом от предсердно-желудочковой борозды по направлению к межпредсердной борозде. Правое предсердие не рекомендуется резецировать ввиду его участия в выработке предсердного натрийуретического гормона, играющего существенную роль в водно-электролитном гомеостазе. Проводится аблация от переднесептальной комиссуры трехстворчатого клапана к ушку правого предсердия с переходом на crista terminalis, и от заднесептальной комиссуры к атриотомному разрезу. 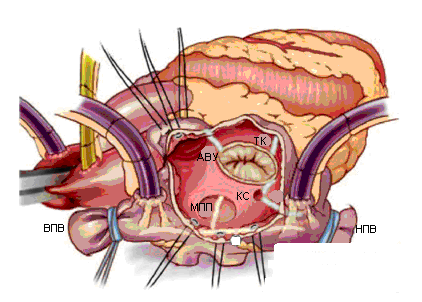
Продольная аблация между верхней полой веной и нижней полой веной соединяется с атриотомным разрезом и с аблацией в области межпредсердной перегородки.
Рекомендуется выполнять также аблацию правого истмуса (от кольца трехстворчатого клапана до коронарного синуса и далее к месту канюляции нижней полой вены) для предотвращения трепетания предсердий, хотя это воздействие не является частью оригинальной процедуры Maze III.
Осложнения мопополярной аблации возникают редко, наиболее опасны: повреждения пищевода, коронарных артерий, кровотечения. Отмечено также более частое развитие посткардиотомного синдрома.
Техника операции с применением биполярной аблации
Биполярная аблация имеет ряд преимуществ перед монополярным вариантом:
- аблация происходит между двумя активными электродами (длина 7-10см), одна из бранш которого располагается со стороны эндокарда, вторая - со стороны эпикарда, или обе эпикардиально, что исключает нежелательное воздействие на окружающие ткани
- быстрота (линия аблации 6-7см осуществляется за 10-15сек)
- контроль трансмуральности по импедансу или температуре
Может применятся как при клапанных коррекциях со вскрытием предсердий, так и без вскрытия последних (протезирование аортального клапана и АКШ, или изолированно).
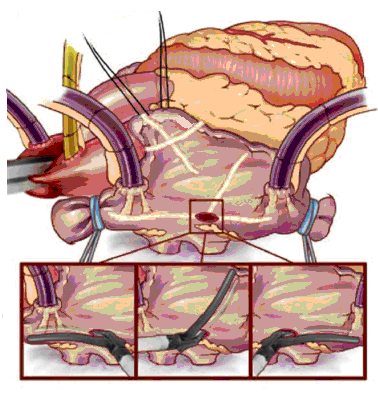
После вскрытия перикарда и подключения искусственного кровообращения на работающем сердце и вспомогательном кровообращении проводится аблация устьев правых легочных вен, затем сердце ротируется и выполняется аблация устьев левых легочных вен и ушка левого предсердия. Рекомендуется для достижения полного блока проведения осуществлять не менее 2-х аблационных захватов легочных вен с прилегающей стенкой левого предсердия.
 |
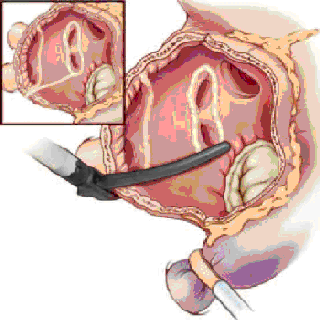 |
 |
| Биполярная аблация в левом предсердии | ||
После проведения кардиоплегии проводится стандартная левая атриотомия. Выполняются соединительные аблации между площадками правых и левых легочных вен (одна при размерах левого предсердия до 55мм, две – при 55мм и более), ушком левого предсердия и задней полуокружностью митрального клапана. Ушко левого предсердия ушивается изнутри или резецируется изначально. При больших размерах левого предсердия (более 60мм) выполняется атриопластика.
В правом предсердии при отсутствии необходимости коррекции трикуспидального порока проводятся аблационные воздействия свободной стенки и ушка правого предсердия. Одна из бранш биполярного устройства вводится в просвет правого предсердия через небольшой разрез внутри кисетного шва, наложенного вблизи межпредсердной борозды.
Миниинвазивные методики хирургического лечения фибрилляции предсердий
Для хирургического лечения изолированной фибрилляции предсердий при отсутствии структурной патологии сердца предложены следующие методы:
Монополярная эпикардиальная аблация из правосторонней миниторакотомии с видеоподдержкой или полностью торакоскопическая
Выполняется по методике “box lesion”, что означает изоляцию легочных вен единым блоком.

Аблацирующее устройство позиционируется на заднюю стенку левого предсердия с применением специальных проводников через поперечный и косой синусы сердца.
Виды устройств
- неорошаемая радиочастотная аблация с внутренним охлаждением (используется устройство с встроенным многополюсным электродом и вакуумным подключением для лучшего позиционирования и контакта с эпикардом.)

- микроволновая аблация (многополюсная гибкая антенна)
 |
 |
- ультразвуковая аблация на основе высокоинтенсивного фокусированного УЗ (многополюсной орошаемый циркулярный электрод)

Выполняется с использованием гибких биполярных электродов-зажимов по “вертикальной” методике (раздельная изоляция правых и левых легочных вен) или по “латеральной” методике, напоминающей “box lesion”.

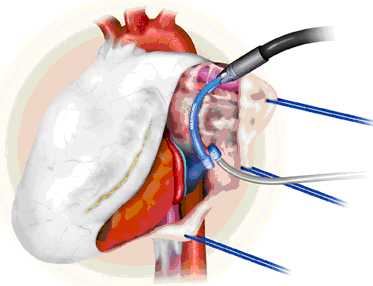
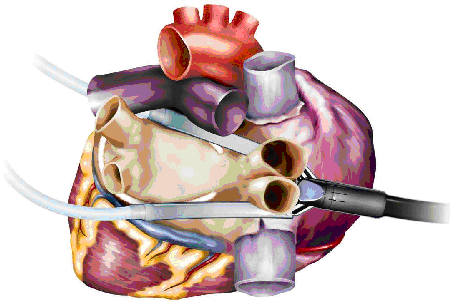
Операция предполагает также пересечение биполярной коагуляцией связки Маршалла, удаление ушка левого предсердия или его клипирование, а также выполнение эпикардиального мэппинга для определения полноты создания блока проведения (высокочастотная стимуляция легочных вен 800 имп/мин с определением замедления сердечного ритма и снятием предсердной электрограммы до и после аблации).
| Биполярная аблация | Moнополярная аблация |
|---|---|
| Ткань миокарда равномерно распределяется между браншами и воздействие происходит только между ними, исключая распространение энергии на окружающие органы и ткани | Воздействие производится эпикардиально на фоне циркуляции крови в предсердии (“heat sinking effect” обусловлен эндокардиальной и миокардиальной циркуляцией крови), что требует большей температуры и длительности воздействия |
| Миниинвазивное вмешательство проходит под полным двухсторонним визуальным контролем, предотвращаются такие осложнения, как перфорация или стриктура пищевода, повреждение огибающей ветви левой коронарной артерии, коронарного синуса | Вмешательство проходит под односторонним контролем, а расположение электрода по отношению к левым легочным венам не контролируется (интерпозиция ушка, наличие эпикардиального жира) |
| Возможна более точная препаровка левых легочных вен, в т.ч. связки Маршалла, а также аблация и клипирование ушка левого предсердия (повышает эффективность на 10-12% и устраняет угрозу тромбоэмболических осложнений) | Визуализация ушка, препаровка левых легочных вен невозможна. Эпикардиальный жир, как ткань с небольшим содержанием воды, выступает в роли иэолятора и лимитирует пенетрацию радиочастотной энергии. Создать непрерывное однородное трансмуральное проникновение проблематично. |
| Существует контроль трансмуральности воздействия по анализу импеданса ткани между браншами, что автоматически блокирует излишнее перегревание ткани и риск ее повреждения | Отсутствует контроль трансмуральности воздействия, имеется контроль температуры воздействия |
| Препаровка поперечного синуса проходит более безопасно ретроградным способом с использованием специального навигатора, что практически исключает повреждение правой ветви легочной артерии или полых вен | Препаровка антеградная, то есть “от себя”, что не исключает травмы магистральных сосудов |
| Возможно проведение эпикардиальной стимуляции со стороны правых и левых легочных вен для выявления неполного блока проведения | Возможно проведение стимуляции только общей площадки или правых легочных вен |
| Длительнее, требует поочередного выключения обоих легких | Быстрее, требует раздельной интубации для выключения только правого легкого |
| Требует двухстороннего доступа | Односторонний доступ |
Преимущества миниинвазивной хирургии фибрилляции предсердий
- отсутствие лучевой нагрузки в отличие от эндоваскулярных методик
- аблация анатомическая, под визуальным контролем
- возможность удаления ушка левого предсердия для снижения риска тромбоэмболий
- возможность эффективного воздействия на ганглионарные плексусы.
Показания к хирургическому лечению фибрилляции предсердий
Согласно рекомендациям Европейского кардиологического общества, Американской кардиологической ассоциации, Американского колледжа кардиологии проведение сочетанной операции по устранению фибрилляции предсердий одновременно с другими хирургическими процедурами показано пациентам с симптоматической фибрилляцией предсердий и всем пациентам, которым хирургическое пособие по фибрилляции предсердий может быть осуществлено с минимальным риском. Вид хирургического пособия и его объем определяются оперирующим кардиохирургом. Пациентам при пароксизмальной и персистирующей фибрилляции предсердий при одномоментной корреции митрального порока показано проведение аблации в левом предсердии, при постоянной форме фибрилляции предсердий или одномоментой коррекции митрально-трикуспидального порока показано проведение биатриальной аблации. При операциях по поводу ИБС или аортального порока проводится эпикардиальная аблация устьев легочных вен и ушка левого предсердия с перевязкой (ампутацией) последнего.
Факторы, определяющие эффективность хирургического устранения фибрилляции предсердий
- продолжительность фибрилляции предсердий
- размер левого предсердия
- амплитуда f-волн в отведении V1 (более 0,1мВ)
- диастолическая дисфункция миокарда
- наличие сопутствующей ИБС
- трехклапаная коррекция
Показания к миниинвазивной хирургии фибрилляция предсердий у пациентов с изолированной фибрилляции предсердий
- симптомная фибрилляция предсердий, рефрактерная к медикаментозной терапии и пациент предпочитает хирургическое вмешательство
- эпизоды тромбоэмболии в анамнезе
- противопоказания или трудности антикоагулянтной терапии
- неэффективность эндоваскулярных катетерных методик или наличие противопоказаний к их проведению (тромбоз ушка левого предсердия)
Противопоказания к миниинвазивной хирургии фибрилляции предсердий
- тромбоз ушка левого предсердия (для монополярной аблации)
- наличие синдрома слабости синусового узла
- спаечный процесс в полости перикарда (предшествующие операции со вскрытием перикарда)
- спаечный процесс в плевральных полостях (перенесенные пневмонии, плевриты)
- ХОБЛ в средней и тяжелой степени (затруднено продолжительное проведение односторонней вентиляции легких)
- размер левого предсердия более 55 мм
Особенности ведения послеоперационного периода
После проведения операции Maze IV у большинства пациентов в операционной восстанавливается регулярный ритм (синусовый или предсердный), однако в ближайшем послеоперационном периоде пароксизмы фибрилляции предсердий возникают у 40-50% пациентов. Это не указывает на отсутствие эффективности операции, так как необходимо время для рубцевания аблационных линий и ремоделирования предсердий. У большинства таких пациентов уже в госпитальном периоде (70-80%) происходит восстановление синусового ритма на фоне приема обычной антиаритмической терапии. У остальных пациентов перед выпиской рекомендуется провести электрическую кардиоверсию. Оценку результатов операции принято проводить через 3 месяца.
В операционной: болюсное внутривенное введение 300 мг амиодарона, затем продолжение инфузии до 1 200мг в течение последующих 24 часов. При отсутствии АВ-блокады более 1 степени и брадикардии менее 50 ударов в минуту продолжение приема амиодарона по 200 мг каждые 8 часов в течение 2-х недель, затем по 200 мг ежедневно в течение 3 месяцев. При наличии противопоказаний к амиодарону, используются соталол (суточная доза 240-320 мг), пропафенон (450-600 мг), дофетилид (500-1 000 мкг), флекаинид (200-300 мг).
При возниковении брадикардии менее 60 ударов в минуту, рекомендовано проводить временную электрокардиостимуляцию в режиме AAI, DDD (временные миокардиальные электроды подшивают к правому предсердию и правому желудочку). Временная электрокардиостимуляция может проводится до 10 суток, затем решается вопрос о постановке постоянного водителя ритма.
Антикоагулянтная терапия проводится стандартно приемом варфарина (МНО 2,0-3,0) в течение 3 месяцев. Варфарин может быть отменен через 3 месяца, если:
- синсовый ритм в течение последних 4-х недель (холтеровский мониторинг)
- восстановлена транспортная функция предсердий (ЭхоКГ: A-wave 10 cm/s)
- отсутствуют другие показания к приему варфарина (искусственные протезы сердца)
У пациентов с фибрилляцией предсердий через 3, 6 и 12 месяцев следует провести кардиоверсию при отсутствии тромбов в левом предсердий (чреспищеводное ЭхоКГ).
Хирургическое лечение фибрилляции предсердий в Беларуси - европейское качество за разумную цену
РНПЦ "Кардиология", Минск

© Размещено только для ознакомления. Любое копирование и использование статьи или ее фрагментов запрещено.


