 На первом месяце внутриутробного развития формируется сердечная трубка. Она состоит из четырех отделов: первичного предсердия, первичного желудочка, луковицы сердца и артериального ствола (рис. 1 А). Кровь входит через венозный синус в первичное предсердие, а выходит через артериальный ствол. На втором месяце внутриутробного развития сердечная трубка превращается в сердце, состоящее из двух предсердий, двух желудочков и двух магистральных артерий.
На первом месяце внутриутробного развития формируется сердечная трубка. Она состоит из четырех отделов: первичного предсердия, первичного желудочка, луковицы сердца и артериального ствола (рис. 1 А). Кровь входит через венозный синус в первичное предсердие, а выходит через артериальный ствол. На втором месяце внутриутробного развития сердечная трубка превращается в сердце, состоящее из двух предсердий, двух желудочков и двух магистральных артерий.
Содержание:
Межжелудочковая перегородка и производные эндокардиальных валиков
Артериальные дуги и проводящая система сердца
Перестройка кровообращения после рождения
Эмбриональное развитие
На первом месяце внутриутробного развития формируется сердечная трубка. Она состоит из четырех отделов: первичного предсердия, первичного желудочка, луковицы сердца и артериального ствола (рис. 1.А). Кровь входит через венозный синус в первичное предсердие, а выходит через артериальный ствол. На втором месяце внутриутробного развития сердечная трубка превращается в сердце, состоящее из двух предсердий, двух желудочков и двух магистральных артерий. Переход от четырех отделов к шести происходит за счет разделения проксимального и дистального отделов сердечной трубки: предсердие разделяется на правое и левое, а артериальный ствол на аорту и легочный ствол. В отличие от предсердий, желудочки образуются из разных отделов: левый — из первичного желудочка, а правый — из луковицы сердца. Когда сердечная трубка отклоняется вправо, образуя петлю, луковица сердца и первичный желудочек прилегают одна к другому (рис. 1. Б и В). Одновременно с формированием двух предсердий АВ-канал разделяется эндокардиальными валиками на трикуспидальное и митральное отверстия, изначально соединяющиеся с первичным желудочком. Для формирования двух параллельных насосов необходимо, чтобы каждый желудочек соединился со своим АВ-клапаном с проксимального конца и с соответствующей магистральной артерией — с дистального. Соединение предсердий с желудочками происходит за счет перемещения АВ-канала вправо, а межжелудочковой перегородки влево (рис. 1. Г и Д), при этом правый желудочек сообщается с правым предсердием.
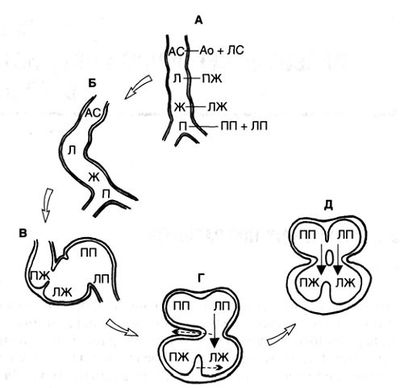
Рисунок 1. Образование четырехкамерного сердца из сердечной трубки. А. Сердечная трубка, состоящая из четырех отделов. Из первичного предсердия образуются правое и левое предсердия; первичный желудочек становится левым желудочком; луковица сердца превращается в правый желудочек; артериальный ствол разделяется на аорту и легочный ствол. Проксимальный и дистальный концы сердечной трубки фиксированы. Б. Сердечная трубка за счет неравномерного роста отклоняется вправо. В. Сердечная трубка складывается таким образом, что первичный желудочек (будущий левый желудочек) и луковица сердца (будущий правый желудочек) прилегают один к другой. Г. Правое и левое предсердия соединяются АВ-каналом с левым желудочком. Затем АВ-канал смещается вправо, располагаясь над обоими желудочками. Д. Дорсальный и вентральный эндокардиальные валики растут навстречу друг другу, разделяя АВ-канал на митральное и трикуспидальное отверстия. Ао — аорта; АС — артериальный ствол; Ж — первичный желудочек; Л — луковица сердца; ЛЖ — левый желудочек; ЛП — левое предсердие; ЛС — легочный ствол; П — первичное предсердие; ПЖ — правый желудочек; ПП — правое предсердие.
На дистальном конце сердечной трубки происходят более сложные превращения. Дистальная часть луковицы сердца разделяется на два мышечных образования — субаортальный и подлегочный конусы. Последний удлиняется, а первый укорачивается и рассасывается, по мере того как аорта сдвигается назад и соединяется с левым желудочком.
Процесс развития сердца очень сложен, и ошибки могут происходить на самых разных его этапах; в результате этих ошибок формируются врожденные пороки сердца — самые частые пороки развития у человека. Врожденные пороки сердца очень разнообразны, и разобраться в них трудно, однако если знать эмбриональное развитие сердца, сделать это значительно легче. Дело в том, что при пороках сердца его структуры остаются в состоянии, характерном для эмбриона. Это может происходить со всеми описанными выше структурами. Например, для соединения трехстворчатого клапана с правым желудочком необходимо смещение АВ-канала вправо. Если этот процесс нарушается, образуется единственный левый желудочек (вариант единственного желудочка); при этом оба АВ-клапана или один общий АВ-клапан соединяются с левым желудочком, а от правого остается лишь небольшая рудиментарная камера выносящего тракта. Такое расположение соответствует эмбриональному сердцу сразу после формирования петли (рис. 1. В). Если нарушается резорбция субаортального конуса, магистральные сосуды неправильно соединяются с желудочками. Формируется двойное отхождение магистральных артерий от правого желудочка — порок, при котором оба магистральных сосуда отходят от правого желудочка. Если нарушается разделение артериального ствола на аорту и легочный ствол, остается характерный для плода общий артериальный ствол. Ниже описываются нормальное развитие сердца и его нарушения, ведущие к формированию врожденных пороков сердца.
Формирование сердечной петли
Сердце — первый орган, который при развитии эмбриона нарушает двустороннюю симметрию. Это происходит, когда сердечная трубка изгибается вперед и направо, образуя так называемую d-петлю (правую петлю). При этом луковица сердца, из которой потом образуется правый желудочек, смещается вправо, а первичный желудочек (будущий левый желудочек) оказывается слева. Потом образовавшееся сердце слегка поворачивается, так что будущий правый желудочек располагается спереди от левого.
Если сердечная трубка изгибается не вправо, а влево (l-петля, или левая петля), расположение желудочков в грудной полости оказывается противоположным: морфологически правый желудочек оказывается слева, а морфологически левый — справа. Все другие органы также могут располагаться обратным образом относительно сагиттальной плоскости — это состояние называется situs inversus (обратное расположение внутренних органов). Стоит отметить, что при situs inversus сердце почти всегда развивается нормально. В то же время, если l-петля образуется при нормальном расположении остальных органов, могут формироваться грубые пороки сердца. Неудивительно, что нарушение столь раннего этапа развития сердца ведет к нарушениям на последующих этапах. При образовании l-петли смещение АВ-канала часто нарушается, что ведет к формированию единственного левого желудочка (см. выше). Если смещение АВ-канала все же происходит, то правое предсердие соединяется с левым желудочком, а левое предсердие — с правым желудочком, поскольку, в отличие от желудочков, расположение предсердий остается нормальным. Если при этом желудочки нормально соединяются с магистральными артериями (то есть легочный ствол выходит из правого желудочка, а аорта из левого), образуется изолированная инверсия желудочков. Однако чаще при l-петле магистральные сосуды соединяются с желудочками неправильно, так что из правого желудочка выходит аорта, а из левого — легочный ствол. В итоге левый желудочек оказывается между правым предсердием и легочным стволом, а правый — между левым предсердием и аортой. Поскольку последовательность кровообращения при этом пороке не нарушена, он называется корригированной транспозицией магистральных артерий или просто l-транспозицией.
Межпредсердная перегородка
Первичное предсердие делится на две камеры перегородкой, которая образуется из трех структур: первичной перегородки, вторичной перегородки и небольшого участка эндокардиальных валиков (рис. 2). Первичная перегородка появляется в виде серповидного образования, которое растет от верхней стенки предсердия по направлению к АВ-каналу; сообщение между двумя предсердиями, называемое ostium primum, по мере роста перегородки уменьшается (рис.2, А, Б и В). Перед тем как ostium primum полностью закроется, выше него образуются множественные отверстия (рис.2, В); они сливаются, образуя ostium secundum — отверстие, через которое продолжается сброс крови справа налево после закрытия ostium primum (рис. 2, Г и Д). Вторичная перегородка начинает расти от верхней стенки предсердия несколько справа от первичной перегородки. Она растет вдоль первичной перегородки, при этом ее вогнутый край не смыкается, оставляя в центре перегородки отверстие — овальное окно (рис. 2, В, Г и Д). Тонкая пластинка первичной перегородки образует заслонку овального окна, которая действует как клапан, обеспечивающий у плода сброс крови справа налево (рис. 2, Д).
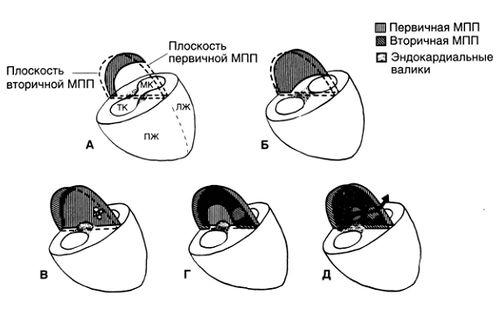
Рисунок 2. Формирование межпредсердной перегородки и овального окна. А, Б. Формирование первичной межпредсердной перегородки. В. Вторичная межпредсердная перегородка полностью разделяет предсердия за исключением небольшого сообщения в середине — овального окна, окруженного слегка приподнятым краем овальной ямки. Овальное окно прикрыто тканью первичной перегородки, образующей заслонку овального окна. Небольшая часть межпредсердной перегородки, прямо над АВ-клапанами, образуется из эндокардильных валиков. Последние также образуют самую верхнюю часть межжелудочковой перегородки и часть трехстворчатого и митрального клапанов. Г. Слияние отверстий первичной перегородки с формированием ostium secundum. Д. Закрытие ostium primum. ЛЖ — левый желудочек; МК — митральный клапан; МПП — межпредсердная перегородка; ПЖ — правый желудочек; ТК — трехстворчатый клапан.
Дефекты межпредсердной перегородки бывают трех типов: типа ostium primum, типа ostium secundum и типа sinus venosus. Дефекты типа ostium secundum возникают в том случае, если заслонки овального окна недостаточно, чтобы полностью его закрыть. Во время развития вторичной перегородки такая ситуация наблюдается в норме, однако когда вторичная перегородка формируется полностью, овальное окно должно закрываться. При дефектах типа sinus venosus дефицита ткани нет, но структуры, образующиеся из правого рога венозного синуса (верхняя полая вена), неправильно располагаются относительно межпредсердной перегородки, охватывая ее с двух сторон. Дефекты межпредсердной перегородки типа ostium primum рассматриваются ниже вместе с другими формами открытого АВ-канала.
Межжелудочковая перегородка и производные эндокардиальных валиков
Межжелудочковая перегородка состоит из мембранозной и мышечной частей, а последняя, в свою очередь, делится на три части, имеющие разное происхождение: трабекулярную, в выносящем тракте правого желудочка, в приносящих трактах желудочков. Трабекулярная часть составляет основную массу перегородки; она развивается из тканевого выступа, лежащего между первичным желудочком (будущий левый желудочек) и луковицей сердца (будущий правый желудочек). При недоразвитии этой части развиваются трабекулярные дефекты межжелудочковой перегородки. Часть перегородки в области выносящего тракта правого желудочка (инфундибулярная, надгребневая) формируется за счет продолжения вниз перегородки артериального ствола, отделяющей аорту от легочного ствола. Она располагается выше наджелудочкового гребня — мышечного тяжа, выступающего в правый желудочек. Дефекты этой области называются инфундибулярными дефектами межжелудочковой перегородки. Дефекты приносящей части межжелудочковой перегородки представляют собой разновидность открытого АВ-канала и рассматриваются ниже. Чаще всего дефекты межжелудочковой перегородки возникают в месте соприкосновения трех ее мышечных частей — рядом с мембранозной частью. Они называются перимембранозными дефектами межжелудочковой перегородки. Поскольку к дефектам в этой области перегородки может вести недоразвитие любой из ее мышечных частей, неудивительно, что они встречаются чаще всего.
Приносящая часть межжелудочковой перегородки и самая нижняя часть межпредсерднои перегородки развиваются из эндокардиальных валиков, поэтому рассматриваются вместе с АВ-каналом. Вначале АВ-канал соединяет предсердия с первичным (то есть будущим левым) желудочком, но позже за счет смещения АВ-канала вправо, а приносящей части межжелудочковой перегородки влево он располагается над обоими желудочками (рис.1). В последующем эндокардиальные валики разрастаются и образуют нижнюю часть межпредсердной и приносящую часть межжелудочковой перегородки, разделяя АВ-канал на трикуспидальное и митральное отверстия. Дефекты развития эндокардиальных валиков могут приводить к разным формам открытого АВ-канала. Более легкая из них — это частично открытый АВ-канал, при котором имеется большой дефект межпредсердной перегородки типа ostium primum, расщепление передней (перегородочной) створки митрального клапана, ее низкое прикрепление, а также незначительный дефект межжелудочковой перегородки прямо под АВ-клапанами. Более тяжелая форма — это полностью открытый, или общий, АВ-канал, при котором имеются сплошной дефект межпредсердной и межжелудочковой перегородок, общий АВ-клапан, сидящий верхом на межжелудочковой перегородке, и нарушения самого клапана. Реже нарушение развития эндокардиальных валиков приводит к изолированному расщеплению створок митрального клапана или изолированным дефектам приносящей части межжелудочковой перегородки.
Легочные вены
Зачатки легких отпочковываются от передней кишки эмбриона, и венозный отток от них осуществляется через эмбриональное легочное венозное сплетение в кардинальные и желточные вены (рис. 3). Общая легочная вена развивается из задней стенки левого предсердия в виде небольшого выпячивания, которое увеличивается и соединяется с легочным венозным сплетением. Венозный отток от легких через общую легочную вену постепенно возрастает, а анастомозы с системой кардинальных и желточных вен редуцируются. Поскольку общая легочная вена встраивается в заднюю стенку левого предсердия, то легочные вены в последующем впадают непосредственно в левое предсердие (рис.3, А). Если общая легочная вена не развивается или не сообщается с легочным венозным сплетением, венозная система легких остается в эмбриональном состоянии и формируется полное аномальное впадение легочных вен в производные кардинальных вен (система верхней полой вены) или желточных вен (воротная система) (рис. 3, В). Еще один порок этой группы — трехпредсердное сердце, при котором общая легочная вена не встраивается в предсердие, и коллектор легочных вен оказывается отделен от левого предсердия мембраной, образующей стеноз (рис. 3, Б).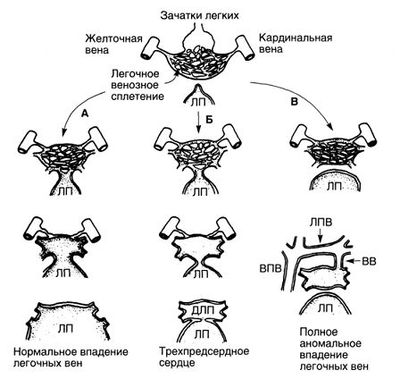
Рисунок 3. Развитие легочных вен в норме, при трехпредсердном сердце и при полном аномальном впадении легочных вен. А. Нормальное развитие легочных вен. Б. Трехпредсердное сердце. Между коллектором легочных вен и левым предсердием формируется сужение, благодаря чему образуется дополнительное левое предсердие, куда впадают легочные вены. В. Полное аномальное впадение легочных вен. ВВ — вертикальная вена; ВПВ — верхняя полая вена; ДЛП — дополнительное левое предсердие; ЛП — левое предсердие; ЛПВ — левая плечеголовная вена.
Артериальный ствол
Артериальный ствол — самая дистальная часть сердечной трубки. Из него развиваются аорта и легочный ствол, которые разделяются и соединяются с соответствующими желудочками. При развитии артериального ствола происходят следующие изменения: пролиферация клеток в складках артериального ствола; миграция в артериальный ствол клеток нервного гребня; резорбция субаортального конуса; смешение артериального ствола влево. Ниже рассматриваются эти изменения и те пороки, которые формируются при их нарушении.
В артериальном стволе имеются эндокардиальные утолщения — складки артериального ствола, аналогичные эндокардиальным валикам АВ-канала; так же как эндокардиальные валики разделяют АВ-канал, эти складки разделяют артериальный ствол. Они растут навстречу друг другу с дорсальной и вентральной стороны; при этом в дистальной части луковицы сердца образуются выносящие тракты правого и левого желудочков, а в артериальном стволе — аортальный клапан и клапан легочной артерии.
Одновременно с этим происходит разделение вентральной аорты путем инвагинации ее стенки; образующаяся при этом перегородка затем сливается с перегородкой, образующейся из складок артериального ствола, завершая разделение магистральных артерий. Для формирования перегородки артериального ствола необходима миграция в нее клеток нервного гребня. Если миграции этих клеток не происходит, разделение артериального ствола нарушается, однако, почему это происходит, не ясно: то ли просто из-за количественной нехватки клеток, то ли из-за отсутствия каких-то влияний, оказываемых клетками нервного гребня. Как бы то ни было, в результате формируется общий артериальный ствол. При этом пороке инфундибулярная часть межжелудочковой перегородки отсутствует, а вместо двух полулунных клапанов имеется общий клапан артериального ствола. Легочные артерии могут отходить от общего артериального ствола разными способами.
Поскольку изначально артериальный ствол располагается над будущим правым желудочком, для правильного соединения магистральных артерий с желудочками его аортальная часть должна сместиться влево (чтобы аорта оказалась над левым желудочком). Это происходит за счет резорбции субаортального конуса. Если субаортальный конус не рассасывается, артериальный ствол не смещается и формируется двойное отхождение магистральных артерий от правого желудочка. Иногда вместо субаортального конуса резорбции подвергается подлегочный конус, при этом с левым желудочком соединяется легочный ствол, а с правым — аорта; формируется транспозиция магистральных артерий, или d-транспозиция. Однако даже при резорбции субаортального конуса смещение артериального ствола может быть недостаточным; в таком случае инфундибулярная часть межжелудочковой перегородки не соединяется с остальной перегородкой. Обычно она смещается в сторону передней части выносящего тракта правого желудочка. При этом формируется тетрада Фалло — инфундибулярный дефект межжелудочковой перегородки, декстропозиция аорты и обструкция выносящего тракта правого желудочка. Если инфундибулярная часть межжелудочковой перегородки смещается назад, возникают подклапанный аортальный стеноз и вторичное недоразвитие дуги аорты — коарктация аорты.
Артериальные дуги
У эмбриона вентральная и дорсальная аорты, продолжающиеся краниально в виде вентральных и дорсальных корней аорты, соединяются между собой шестью парами артериальных дуг (рис.4). 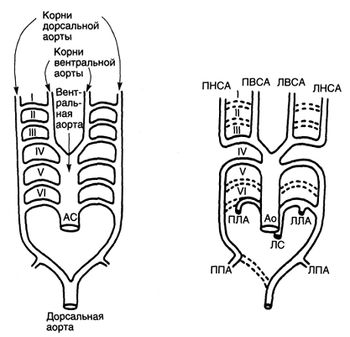
Рисунок 4. Схема развития артериальных дуг. Слева изображена вентральная аорта и шесть пар артериальных дуг, соединяющих ее с дорсальной аортой. Артериальные дуги развиваются последовательно, и их дегенерация также происходит не одновременно. В результате дегенерации одних и сохранения других артериальных дуг и сегментов корней дорсальной аорты образуются сосуды, изображенные справа. Сосуды нарисованы так, чтобы было понятно их происхождение, анатомические соотношения не соблюдены. Ао — аорта; АС — артериальный ствол; ЛВСА — левая внутренняя сонная артерия; ЛЛА — левая легочная артерия; ЛНСА — левая наружная сонная артерия; ЛПА — левая подключичная артерия; ЛС — легочный ствол; ПВСА — правая внутренняя сонная артерия; ПЛА — правая легочная артерия; ПНСА — правая наружная сонная артерия; ППА — правая подключичная артерия.
Три из них исчезают бесследно (первая, вторая и пятая пары), а еще одна (третья пара) соединяет наружную и внутреннюю сонные артерии. Проксимальные части шестой пары дают начало правой и левой легочным артериям, а дистальная часть левой шестой артериальной дуги превращается в артериальный проток; иногда дистальная часть правой шестой артериальной дуги остается в виде правого артериального протока. Левая четвертая артериальная дуга превращается в левую дугу аорты, а правая четвертая дуга образует проксимальную часть правой подключичной артерии. Артериальные дуги и их производные у эмбриона человека схематично изображены на рис. 4. Для понимания пороков развития аорты Эдвардсом была предложена схема гипотетической двойной дуги аорты (рис. 5).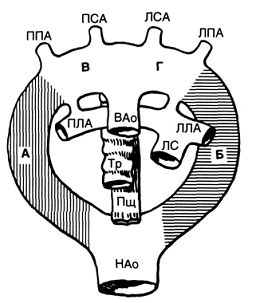
Рисунок 5. Схема гипотетической двойной дуги аорты по Эдвардсу. Редукция заштрихованного участка, отмеченного буквой А, приводит к нормальному формированию левой дуги аорты. При редукции заштрихованного участка, отмеченного буквой Б, формируется правая дуга аорты. Редукция участка В приводит к левой дуге аорты с аберрантной правой подключичной артерией, а участка Г — к правосторонней дуге аорты с аберрантной левой подключичной артерией. Поскольку редукция эмбриональных сосудов может произойти практически в любом месте, разнообразие пороков очень велико, однако четыре перечисленные выше встречаются чаще всего. Если редукции не происходит вообще, образуется двойная дуга аорты. ВАо — восходящая аорта; ЛЛА — левая легочная артерия; ЛПА — левая подключичная артерия; ЛС — легочный ствол; ЛСА — левая сонная артерия; НАо — нисходящая аорта; ПЛА — правая легочная артерия; ППА — правая подключичная артерия; ПСА — правая сонная артерия; Пщ — пищевод; Тр — трахея.
В основе каждого из дефектов дуги аорты лежит редукция соответствующего сегмента на этой схеме; если редукции ни одного сегмента не происходит, образуется двойная дуга аорты.
Проводящая система сердца
Перед образованием межпредсердной и межжелудочковой перегородок в синоатриальном, АВ-, вентрикулобульбарном и бульботрункальном соединениях образуются кольца из специализированных проводящих клеток. Эти клетки, видимо, образуются из кардиомиоцитов под действием неизвестных влияний. При изгибе сердечной трубки АВ-кольцо оказывается в основании межпредсердной перегородки, так что часть клеток этого кольца соприкасается с верхней частью вентрикулобульбарного кольца, обеспечивая тем самым связь между первичным АВ-узлом и пучком Гиса. Если эти кольца не соединяются, развивается врожденная АВ-блокада. При смещении межпредсердной и межжелудочковой перегородок друг относительно друга (например, при корригированной транспозиции магистральных артерий или при единственном желудочке) в норме расположенный сзади АВ-узел не может соединиться с пучком Гиса. В этой ситуации с вентрикулобульбарным кольцом соединяется передняя часть АВ-кольца, что приводит к аномальному расположению пучка Гиса.
Кровообращение плода и его перестройка после рождения
Наиболее важные изменения кровообращение плода претерпевает сразу после рождения, когда функция газообмена от плаценты переходит к легким, однако некоторые изменения происходят и до, и после этого. Основные сведения о физиологии и патофизиологии кровообращения плода получены в опытах на овечьих плодах, однако ЭхоКГ человеческого плода на разных сроках беременности показало, что кровообращение человеческого и овечьего плода и его реакции на разные воздействия в целом схожи.
Кровообращение плода
У взрослых млекопитающих кровообращение последовательное: из правых отделов сердца в легкие, оттуда в левые отделы сердца, затем в большой круг и снова в правые отделы. Сердечным выбросом при этом считается объем крови, выбрасываемый за одну минуту любым из желудочков. Однако у плода кровообращение непоследовательное, поскольку из правого желудочка лишь незначительная часть крови поступает в легкие. Большая часть крови из правого желудочка через артериальный проток сразу поступает в большой круг (рис. 6 и 7). Поэтому у плода за сердечный выброс мы примем общий сердечный выброс обоих желудочков. Общий сердечный выброс у овечьего плода с середины беременности до рождения в пересчете на вес плода составляет от 450 до 500 мл/кг/мин.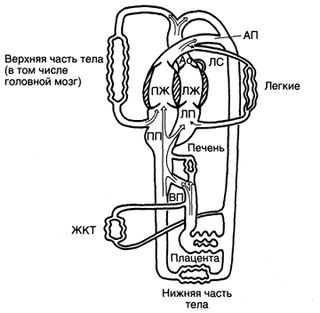
Рисунок 6. Кровообращение плода (см. текст). Ао — аорта; АП — артериальный проток; ВП — венозный проток; ЛЖ — левый желудочек; ЛП — левое предсердие; ЛС — легочный ствол; ПЖ — правый желудочек; ПП — правое предсердие. Rudolph A. M.: Congenital Diseases of the Heart. Chicago, Year Book, 1974.
Около 40% общего сердечного выброса, то есть 200 мл/кг/мин, поступает в плацентарное кровообращение. Насыщенная кислородом кровь из плаценты возвращается по пупочной вене; последняя проходит через пуповину и впадает в воротную систему печени в области ее ворот. От пупочной вены отходят воротные ветви к левой доле печени, после чего от нее ответвляется венозный проток, а она поворачивает направо, чтобы соединиться с воротной веной. Таким образом, воротные вены, снабжающие правую долю печени, несут смешанную кровь, богатую кислородом из пупочной вены и бедную кислородом из воротной вены. Левая доля печени снабжается кровью из ветвей пупочной вены, несущих насыщенную кислородом кровь. Из-за этого кровь в левой печеночной вене содержит больше кислорода, чем в правой. Благодаря венозному протоку, соединяющему пупочную вену с нижней полой веной, примерно половина крови из пупочной вены минует печень; другая половина возвращается в нижнюю полую вену, пройдя через сосуды печени.
Несмотря на то что в проксимальную часть нижней полой вены поступает кровь из ее дистальной части, венозного протока и печеночных вен, полного смешивания крови из разных источников там не происходит. Кровь из венозного протока и левой печеночной вены, наиболее богатая кислородом, из правого предсердия по большей части сбрасывается в левое через овальное окно; тем самым левые отделы сердца получают наиболее оксигенированную кровь. Бедная кислородом кровь из правой печеночной вены и дистальной части нижней полой вены проходит через правое предсердие и поступает в основном в правый желудочек, хотя некоторая ее часть также сбрасывается в левое предсердие через овальное окно.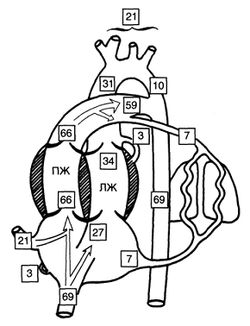
Рисунок 7. Распределение сердечного выброса между желудочками сердца и крупными сосудами. В квадратиках указаны проценты от общего сердечного выброса. Данные получены в экспериментах на овечьих плодах (см. текст). ЛЖ — левый желудочек; ПЖ — правый желудочек. Rudolph A M.: Congenital Diseases of the Heart. Chicago, Year Book, 1974.
У овечьих плодов через нижнюю полую вену осуществляется около 70% общего венозного возврата. Примерно треть крови из нижней полой вены через овальное окно поступает в левое предсердие, а остальные две трети из правого предсердия поступают в правый желудочек. Кровь из верхней полой вены направляется через трехстворчатый клапан в правый желудочек, и в норме лишь очень небольшая ее часть попадает в левое предсердие через овальное окно. Через верхнюю полую вену к сердцу поступает около 20% общего венозного возврата, поэтому через правый желудочек проходит около двух третей (66%) общего сердечного выброса. Основная часть крови, выбрасываемой правым желудочком в легочный ствол, поступает через артериальный проток в нисходящую аорту (58% общего сердечного выброса), и только 7—8% общего сердечного выброса (то есть 10—15% выброса правого желудочка) попадает в легочные артерии. Левое предсердие получает кровь от легких (7—8% общего сердечного выброса) и через овальное окно из нижней полой вены (около 25% общего сердечного выброса). Таким образом, через левый желудочек проходит около трети (33%) общего сердечного выброса. Около 3% общего сердечного выброса поступает в коронарные артерии и 20% — в сосуды головы, шеи, верхней половины туловища и рук. Оставшиеся 10% общего сердечного выброса из левого желудочка преодолевают перешеек аорты и попадают в нисходящую аорту. Распределение общего сердечного выброса по органам у зрелого овечьего плода выглядит так: миокард — 3—4%, легкие — 7—8%, ЖКТ — 5—6%, головной мозг — 3—4%, почки — 2—3%, плацента — 40%.
У человеческого плода головной мозг по отношению к телу значительно крупнее, чем у овечьего. Поэтому, если мозговой кровоток у человеческого и овечьего плодов и в пересчете на вес мозга одинаковы, выброс левого желудочка, обеспечивающий кровоснабжение мозга, у человеческого плода должен быть выше. По расчетам, у человеческого плода мозг получает от 20 до 30% общего сердечного выброса, поэтому отношение выбросов правого и левого желудочков должно составлять от 1,2:1 до 1,3:1, вместо наблюдающегося у овечьего плода соотношения 2:1. По последним данным ЭхоКГ, это отношение у человеческого плода составляет примерно 1,3:1, то есть 55% общего сердечного выброса приходится на правый желудочек, а остальные 45% — на левый.
РаО2 у плода намного ниже, чем у взрослых. В крови из пупочной вены, поступающей в венозный проток и левую долю печени, то есть до смешения с кровью из воротной и нижней полой вен, РО2 составляет 30—35 мм рт. ст. В дистальной части нижней полой вены, в верхней полой вене и в воротной вене РО2 составляет 12—14 мм рт. ст. В левом предсердии насыщенная кислородом кровь из венозного протока, поступающая через овальное окно, смешивается с небольшим объемом бедной кислородом крови из легочных вен, в результате чего ее РО2 снижается. РаО2 крови, выбрасываемой левым желудочком в восходящую аорту и питающей миокард, головной мозг и верхнюю половину туловища, составляет 24—28 мм рт. ст. В правый желудочек из правого предсердия поступает свыше 90% крови из верхней полой вены и некоторая часть крови из нижней полой вены; РО2 в правом желудочке и легочном стволе составляет 18—19 мм рт. ст. Нисходящая аорта получает кровь в основном из легочного ствола через артериальный проток, но также из восходящей аорты через перешеек аорты. РО2 в нисходящей аорте составляет 20—23 мм рт. ст., тогда как в восходящей — 24—28 мм рт. ст.
Поскольку плод окружен околоплодными водами, давление в его сосудах измеряется относительно давления в амниотической полости. Давление в полых венах и в правом предсердии составляет 3—5 мм рт. ст., а в левом предсердии — 2—4 мм рт. ст. Систолическое давление в правом и левом желудочках примерно одинаково и на поздних сроках беременности равняется 65—70 мм рт. ст. В легочном стволе и аорте давление тоже одинаково, при этом систолическое составляет 65—70 мм рт. ст., а диастолическое — 30—35 мм рт. ст. На поздних сроках беременности систолическое давление в правом желудочке и легочном стволе на 5—8 мм рт. ст. превышает давление в левом желудочке и аорте, возможно, за счет некоторого сужения артериального протока.
Сократимость миокарда плода
У плода диаметр кардиомиоцитов равен 5—7 мкм, тогда как у взрослых он составляет 20—25 мкм. В зрелых кардиомиоцитах миофибриллы строго упорядочены и лежат параллельно друг другу, а у плода миофибрилл меньше и расположены они менее упорядочение Friedman с соавт. в опытах на овечьих плодах показали, что изолированные полоски миокарда плода развивают меньшую силу по сравнению с полосками миокарда взрослых овец в пересчете на массу миокарда. Они объяснили это большим содержанием воды и меньшим числом сократительных элементов в миокарде плода по сравнению со взрослыми.
Долгое время оставалось неясным, способно ли сердце плода увеличивать выброс. Thornburg с соавт. и Gilbert в экспериментах на овечьих плодах быстро вводили жидкость в сосуды плода; выяснилось, что выброс левого и правого желудочка возрастал при увеличении диастолического давления в желудочках до 4—6 мм рт. ст. по сравнению с 2—3 мм рт. ст. в покое; однако при дальнейшем увеличении диастолического давления желудочков выброс не менялся. Снижение диастолического давления в желудочках, наоборот, приводило к резкому падению сердечного выброса. Был сделан вывод, что работа сердца плода подчиняется закону Стерлинга (усиление сокращений сердца при увеличении диастолического объема), но только при низком диастолическом давлении в желудочках. Однако Hawkins с соавт. показали, что сердечный выброс при высоком диастолическом давлении не увеличивался из-за повышения посленагрузки, возникавшего в результате введения жидкости. При фиксации АД сердечный выброс возрастал по мере увеличения диастолического давления в левом желудочке вплоть до 10—12 мм рт. ст. Если снизить посленагрузку у плода путем вентиляции легких, повышение диастолического давления в желудочках позволяет достичь сердечного выброса, свойственного новорожденному ягненку. У новорожденных ягнят сердце способно выбрасывать столько же крови и при таком же диастолическом давлении в желудочках, как и у плода, но при значительно большем АД, что указывает на повышение сократимости миокарда после рождения.
Перестройка кровообращения после рождения
Сразу после рождения происходит два очень важных события: прекращение фетоплацентарного и становление полноценного легочного кровообращения. Сосуды пуповины очень чувствительны к механическому воздействию, особенно растяжению; так, у животных в естественных условиях сосуды пуповины сокращаются после разрыва или перекусывания пуповины. Кроме того, сосуды пуповины сокращаются в ответ на повышение РО2 — возможно, этот механизм ответственен за длительное сокращение сосудов после рождения; тяжелая гипоксия может вызывать расширение сосудов и кровотечение. Прекращение плацентарного кровообращения значительно снижает возврат крови по нижней полой вене. Снижается также кровоток в венозном протоке, который закрывается через 3—7 сут после рождения, вероятно, просто из-за снижения тока крови и давления.
Перестройка легочного кровообращения
Низкий кровоток в легких плода обусловлен высоким легочным сосудистым сопротивлением. У плода в медии мелких артерий легких хорошо развит мышечный слой; сокращение этих артерий поддерживает легочное сосудистое сопротивление на высоком уровне. По мере созревания плода легочное сосудистое сопротивление значительно снижается; это происходит за счет увеличения числа сосудов, а значит, и общей площади поперечного сечения легочного сосудистого русла. Легочные сосуды очень чувствительны к некоторым физиологическим воздействиям и лекарственным средствам. Падение РО2 и рН в крови легочных сосудов ведет к их сужению; причем каждый из этих факторов усиливает действие другого. Эксперименты на ягнятах показали, что сосудосуживающее действие гипоксии усиливается по мере созревания плода. Объяснить это морфологическими изменениями сосудистого русла не удается, поскольку отношение толщины мышечного слоя к диаметру сосуда во второй половине беременности остается постоянным.
Ацетилхолин, гистамин, толазолин и бета-адреностимуляторы, а также брадикинин, простагландины D2, E1, Е2 и простациклин (простагландин I2) оказывают на легочные сосуды плода мощное сосудорасширяющее действие. Лейкотриены, особенно D4, сужают легочные сосуды. Недавно было показано, что N-ω-нитpo-L-аргинин — конкурентный ингибитор NO-синтазы, естественным субстратом которой служит L-аргинин, — вызывает сужение легочных сосудов плода. Это может указывать на то, что в норме некоторое расширение легочных сосудов достигается высвобождением окиси азота (NО) из эндотелия.
Высокое легочное сосудистое сопротивление объясняют гипоксической вазоконстрикцией, поскольку РО2 в сосудах легких плода достаточно низкое. Вентиляция легких воздухом в 4— 10 раз увеличивает легочный кровоток за счет резкого падения легочного сосудистого сопротивления. До рождения РО2 в прекапиллярных артериолах легких примерно равно 18 мм рт. ст. При раздувании легких воздухом РО2 в этих сосудах возрастает за счет простой диффузии кислорода из соседних альвеол.
Снижение легочного сосудистого сопротивления при вентиляции легких объясняли главным образом увеличением оксигенации, отводя механическому растяжению лишь второстепенную роль. Однако недавно в экспериментах на овечьих плодах было показано, что раздувание легких газовой смесью, не меняющей состав газов крови, значительно снижает легочное сосудистое сопротивление. Последующая вентиляция кислородом еще больше усиливает вазодилатацию. Вентиляция легких может влиять на легочные сосуды за счет сил поверхностного натяжения, возникающих при появлении в альвеолах границы раздела фаз между жидкостью и газом, или за счет высвобождения сосудорасширяющих веществ. Эксперименты на овечьих плодах показали, что один из факторов расширения легочных сосудов при раздувании легких — высвобождение простациклина; так, ингибиторы синтеза простагландинов меклофенамовая кислота и индометацин препятствуют расширению легочных сосудов при раздувании легких.
При повышении РО2 в крови легочные сосуды расширяются, даже если легкие не вентилируются. Так, при воздействии на беременную овцу гипербарической оксигенации повышается РО2 в кровотоке плода, и из-за этого снижается легочное сосудистое сопротивление. Кислород действует непосредственно в легких, а не рефлекторно через периферические хеморецепторы. Нам не известно, действует ли кислород непосредственно на гладкие мышцы или способствует местному высвобождению сосудорасширяющих веществ. Высказывалось предположение, что снижение легочного сосудистого сопротивления сразу после рождения происходит под действием брадикинина, который высвобождается при повышении РО2; однако это не до конца объясняет действие кислорода, поскольку уровень брадикинина повышается очень кратковременно.
Недавно было выдвинуто предположение, что сосудорасширяющее действие кислорода опосредуется NО, поскольку блокада синтеза NО значительно снижает, вплоть до полного исчезновения, реакцию легочных сосудов на кислород.
Возможность прямого сосудорасширяющего действия кислорода на гладкомышечные клетки легочных сосудов вновь привлекла к себе внимание после того, как в этих клетках были обнаружены калиевые каналы, чувствительные к кислороду. Препараты, открывающие эти каналы, вызывают расширение, а закрывающие их — сужение легочных сосудов. При гипоксии эти каналы закрыты, а после рождения, когда в легкие поступает кислород, они открываются и способствуют расслаблению гладкомышечных клеток сосудов.
Пока артериальный проток открыт, давление в легочной артерии и аорте одинаково, но когда артериальный проток сужается, легочный ствол и аорта разобщаются и, если легочное сосудистое сопротивление падает, снижается также давление в легочной артерии.
Вначале легочное сосудистое сопротивление снижается за счет вазодилатации. Через 6—8 нед после рождения оно падает еще сильнее за счет истончения мышечного слоя в медии легочных сосудов. Изменения кровотока, сосудистого сопротивления и давления в легочных сосудах после рождения изображены на рис. 8. 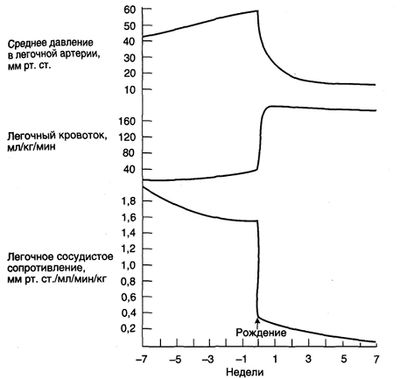
Рисунок 8. Изменения давления в легочной артерии, легочного кровотока и легочного сосудистого сопротивления в перинатальном периоде. Легочное сосудистое сопротивление снижается к концу беременности, в основном за счет увеличения числа сосудов у растущего плода. Во время рождения оно резко падает благодаря расширению сосудов при вентиляции легких воздухом. В дальнейшем легочное сосудистое сопротивление продолжает постепенно снижаться из-за дегенерации гладкомышечных клеток в сосудах. Легочный кровоток до родов увеличивается незначительно, а после — резко возрастает. Давление в легочной артерии сразу после родов падает очень резко, а затем снижается медленнее и через 6—8 нед достигает взрослых значений.
Созревание легочных сосудов после рождения нарушается при состояниях, препятствующих нормальной оксигенации, — например, при заболеваниях легких и пребывании на большой высоте над уровнем моря, — а также при врожденных пороках сердца, особенно тех, которые вызывают легочную гипертензию.
Закрытие овального окна
У плода примерно половина крови в нижнюю полую вену поступает из пупочной вены. Прекращение плацентарного кровообращения значительно снижает объем крови, поступающей в сердце из нижней полой вены, вызывая некоторое падение давления в правом предсердии. Одновременно с этим увеличение легочного кровотока повышает венозный возврат через легочные вены и тем самым поднимает давление в левом предсердии. При таком изменении давлений заслонка овального окна, действуя как клапан, запирает овальное окно. У многих новорожденных овальное окно закрывается не полностью и в течение нескольких месяцев через маленькое отверстие продолжается незначительный сброс слева направо. Небольшое отверстие без сброса слева направо сохраняется в течение всей жизни у 15—20% людей. У новорожденных, а иногда и в более позднем возрасте, при подъеме давления в правом предсердии выше давления в левом предсердии овальное окно может открываться, позволяя крови сбрасываться справа налево.
Закрытие артериального протока
У плода артериальный проток имеет диаметр, сопоставимый с диаметром нисходящей аорты. Артериальный проток соединяет легочный ствол и аорту, но, в отличие от этих сосудов, медия которых состоит преимущественно из эластических волокон, медия артериального протока очень богата мышечной тканью. Раньше считалось, что артериальный проток остается открытым просто за счет высокого давления крови. Однако воздействие индометацина или аспирина — ингибиторов синтеза простагландинов — на беременных животных или непосредственно на плод приводит к сужению артериального протока; при этом давление в легочной артерии возрастает, а давление в артериях большого круга остается неизменным или повышается. Это говорит о том, что проходимость артериального протока у плода поддерживается простагландинами. Расширение артериального протока in vivo происходит под действием простациклина и простагландина Е2, причем к последнему артериальный проток намного более чувствителен. При инкубации ткани артериального протока в среде с арахидоновой кислотой — предшественником простагландинов — образуется большое количество простациклина и лишь немного простагландина Е2. Однако в крови плода уровень простагландина Е2 достаточно высок — в 3—5 раз выше, чем у взрослых.
Остается неясным, какие простагландины воздействуют на артериальный проток — синтезирующиеся местно или циркулирующие в крови. После рождения артериальный проток быстро сокращается и у большинства новорожденных перестает пропускать кровь в течение 10—15 ч. Необратимое закрытие протока за счет тромбоза, пролиферации интимы и разрастания соединительной ткани происходит в течение 3 нед.
Причины закрытия артериального протока после рождения до конца не изучены. До рождения в артериальный проток поступает кровь из легочного ствола, РО2 в котором равно 18—20 мм рт. ст. Известно, что увеличение РО2 в артериальном протоке вызывает его сужение. После рождения легочное сосудистое сопротивление падает и кровь через артериальный проток устремляется в обратном направлении — из аорты в легочный ствол; при этом РО2 в артериальном протоке повышается до 80—90 мм рт. ст. В закрытии протока принимает участие также метаболизм простагландинов; после рождения уровень простагландина Е2 в крови быстро снижается, что способствует закрытию артериального протока.
У недоношенных артериальный проток намного чаще остается открытым, это, возможно, обусловлено тем, что у них слабее выражена сократительная реакция протока на кислород. У недоношенных дольше сохраняется высокий уровень простагландина Е2 в крови. Это может происходить за счет повышенной продукции простагландина Е2 или его замедленного распада в незрелых легких. Этим же, видимо, обусловлена эффективность индометацина, ингибирующего синтез простагландинов, в лечении открытого артериального протока.
После рождения легочное сосудистое сопротивление резко снижается, вследствие чего, пока артериальный проток не закроется, кровь через него течет слева направо (из аорты в легочный ствол). Если легочное сосудистое сопротивление остается высоким из-за гипоксии или других причин, сброс крови через проток происходит справа налево. Артериальный проток может оставаться открытым, если после рождения не происходит повышения РаО2; это часто происходит при рождении и дальнейшем пребывании на высоте более 3 000 м над уровнем моря.
Изменения сердечного выброса и его распределения
Общий сердечный выброс у овечьего плода составляет 450— 500 мл/кг/мин, из которых около 330 мл/кг/мин приходится на правый желудочек, а 170 мл/кг/мин — на левый. В первые дни после рождения общий сердечный выброс возрастает, каждый желудочек начинает выбрасывать примерно по 350 мл/кг/мин. Таким образом, выброс правого желудочка почти не увеличивается, а левого возрастает примерно в два раза. В последующем сердечный выброс довольно быстро падает, достигая в течение 8—10 нед 150 мл/кг/мин, а затем снижается более плавно, достигая взрослых значений 70—80 мл/кг/мин. Увеличение сердечного выброса сразу после рождения может быть обусловлено необходимостью повышения основного обмена для поддержания температуры тела; у новорожденных ягнят повышение сердечного выброса происходит вместе с увеличением потребления кислорода. Изменения основного обмена, происходящие, например, при изменении температуры окружающей среды, повышают потребление кислорода и сердечный выброс. У человеческого плода сердечный выброс в пересчете на вес выше, чем у овечьего, поэтому после рождения он возрастает незначительно.
Высокий сердечный выброс сразу после рождения и его быстрое снижение в течение первых 8 нед жизни связано также с заменой фетального гемоглобина на взрослый. Кривая диссоциации гемоглобина у плода сдвинута влево, что дает преимущества во внутриутробной жизни, поскольку обеспечивает захват кислорода в плаценте. Однако после рождения это становится уже недостатком, поскольку препятствует отдаче кислорода в тканях при высоком РО2, устанавливающемся после рождения.
У новорожденных сердечный выброс в покое относительно высок, поэтому по сравнению со взрослыми они в меньшей степени могут повышать его в ответ на нагрузку. У ягнят на первой неделе жизни сердечный выброс в ответ на быстрое введение жидкости (повышающее давление в левом предсердии более 20 мм рт. ст.) может подняться лишь на 35%. К третьей неделе, когда сердечный выброс в покое падает до 300 мл/кг/мин, он может подняться уже на 50%, а к восьмой неделе, когда в покое он составляет 150 мл/кг/мин, сердечный выброс может возрастать на 70%. Эти данные говорят о том, что сердце новорожденного ягненка обеспечивает высокий сердечный выброс, необходимый для доставки кислорода тканям в покое, но резерв его весьма ограничен. Так, сразу после рождения нагрузка объемом при сбросе крови слева направо переносится плохо, поскольку страдает системный кровоток; а в более позднем возрасте сброс такой же величины не вызывает серьезных нарушений.
Изменения ЧСС и АД
ЧСС плода в норме колеблется от 160 до 180 мин-1. У новорожденных она составляет 120 мин-1 во время сна, повышаясь до 140—160 мин-1 во время бодрствования. У недоношенных ЧСС во время сна несколько выше — в среднем 120—140 мин-1. С возрастом ЧСС постепенно снижается. АД зрелого плода по отношению к амниотической полости равно 60/35 мм рт. ст. У доношенного новорожденного оно составляет примерно 70/50 мм рт. ст., а у недоношенных слегка ниже. С возрастом АД постепенно увеличивается.
Литература
"Детская кардиология" под ред. Дж. Хоффмана, Москва 2006


