 Нестабильная стенокардия и инфаркт миокарда без подъема сегмента ST занимают в США первые места по заболеваемости и смертности; каждый год с этим диагнозом госпитализируется 700 000 человек. Эти состояния составляют вместе с инфарктом миокарда с подъемом сегмента ST часть общего спектра острого коронарного синдрома.
Нестабильная стенокардия и инфаркт миокарда без подъема сегмента ST занимают в США первые места по заболеваемости и смертности; каждый год с этим диагнозом госпитализируется 700 000 человек. Эти состояния составляют вместе с инфарктом миокарда с подъемом сегмента ST часть общего спектра острого коронарного синдрома.
Проявления нестабильной стенокардии весьма разнообразны: от медленно прогрессирующей стенокардии напряжения до постинфарктной стенокардии.
Содержание
Патогенез острого коронарного синдрома
Лечение:
Поскольку инфаркт миокарда без подъема сегмента ST отличается от нестабильной стенокардии лишь повышением уровня маркеров некроза миокарда, их динамику необходимо отслеживать у всех больных с острым коронарным синдромом. Современные диагностические методы позволяют быстро поставить диагноз, оценить риск и начать лечение.
Факторы риска
На высокий риск при нестабильной стенокардии указывают приступы стенокардии в покое (дольше 20 мин), сердечная недостаточность (III тон сердца, застой в малом круге кровообращения, влажные хрипы в легких), систолическая дисфункция левого желудочка, артериальная гипотония, впервые выявленный или усилившийся шум митральной недостаточности, подъем или депрессия сегмента ST на 0,5—1 мм и более в нескольких отведениях и повышение уровня маркеров некроза миокарда. О низком и об умеренном риске говорят короткие приступы стенокардии, отсутствие ишемических изменений сегмента ST, нормальные уровни маркеров некроза миокарда и стабильная гемодинамика.
Оценка риска при нестабильной стенокардии*
| Высокий риск | Средний риск | Низкий риск |
|---|---|---|
| Хотя бы один из следующих признаков | Несоответствие критериям высокого риска и хотя бы один из следующих признаков | Несоответствие критериям высокого и среднего риска |
| Длительный приступ стенокардии (> 20 мин), продолжающийся по настоящее время | Длительный (> 20 мин), но в настоящий момент разрешившийся приступ стенокардии | Учащение или утяжеление стенокардии |
| Отек легких, вероятнее всего, вызванный ишемией миокарда | Стенокардия покоя (> 20 мин или прекратившаяся в покое или после приема нитроглицерина под язык) | Снижение уровня нагрузки, вызывающей стенокардию |
| Стенокардия покоя с подъемом или депрессией сегмента ST > 1 мм | Ночные приступы стенокардии | Впервые возникшая стенокардия (от 2 нед до 2 мес) |
| Стенокардия с появлением или усилением влажных хрипов, III тона или шума митральной регургитации | Стенокардия с преходящими изменениями зубцов Т | Отсутствие новых изменений ЭКГ или нормальная ЭКГ |
| Стенокардия с артериальной гипотонией | Тяжелая стенокардия, впервые возникшая за последние 2 нед | |
| Повышение уровня маркеров некроза миокарда | Патологические зубцы Q или депрессия сегмента ST в нескольких отведениях в покое | |
| Возраст старше 65 лет |
*Эта классификация учитывает клиническую картину и изменения ЭКГ.
ЭКГ при поступлении помогает оценить риск при нестабильной стенокардии. Отклонение сегмента ST (депрессия или преходящий подъем) не менее 0,5 мм или предшествующая блокада левой ножки пучка Гиса говорят о повышенном риске смерти в течение года. Отрицательные зубцы Т самостоятельного прогностического значения не имеют.
При инфаркте миокарда без подъема сегмента ST прогноз хуже, чем при нестабильной стенокардии. На высокую вероятность инфаркта указывают длительная боль в груди (> 60 мин), отклонения сегмента ST (депрессия или преходящий подъем) и впервые возникшая стенокардия (в течение месяца). Уровень сердечных тропонинов I и Т — сократительных белков, поступающих в кровь при некрозе кардиомиоцитов, — независимый неблагоприятный прогностический фактор. По определению Европейского кардиологического общества и Американской коллегии кардиологов повышение сердечных тропонинов при соответствующей клинической картине — это и есть инфаркт миокарда без подъема сегмента ST.
Классификации
Классификация нестабильной стенокардии по Браунвальду
Классификация нестабильной стенокардии по Браунвальду представлена в таблице.
| Класс | Описание |
|---|---|
| I | Стенокардия напряжения |
| Впервые возникшая, тяжелая или прогрессирующая стенокардия напряжения в течение последних 2 мес | |
| Учащение приступов стенокардии | |
| Снижение уровня нагрузки, при которой возникает стенокардия | |
| Отсутствие стенокардии покоя в течение последних 2 мес | |
| II | Стенокардия покоя, подострая |
| Стенокардия покоя в течение последнего месяца, но не последних 48 ч | |
| III | Стенокардия покоя, острая |
| Стенокардия покоя в течение последних 48 ч | |
| Обстоятельства возникновения | |
| А | Вторичная |
| Спровоцированная некоронарной патологией, например анемией, инфекцией, тиреотокискозом, гипоксией | |
| В | Первичная |
| С | Постинфарктная |
| В течение 2 нед после инфаркта миокарда | |
*Эта классификация используется для оценки риска. Она учитывает тяжесть стенокардии и обстоятельства ее возникновения.
В основе этой классификации лежат характеристики боли в груди и ее причины, Чем выше класс нестабильной стенокардии по Браунвальду, тем выше риск повторной ишемии и смерти в течение 6 мес. Эта классификация, однако, не учитывает таких важных признаков, как возраст, сопутствующие заболевания (например, сахарный диабет, ХПН), изменения ЭКГ и повышение маркеров некроза миокарда.
Классификация Ризика
Классификация Ризика учитывает характеристики боли в груди и изменения ЭКГ.
| Класс | Свойства |
|---|---|
| IA | Усиление стенокардии без изменений ЭКГ |
| IB | Усиление стенокардии с изменениями ЭКГ |
| II | Впервые возникшая стенокардия напряжения |
| III | Впервые возникшая стенокардия покоя |
| IV | Продолжительная стенокардия покоя с изменениями ЭКГ |
В исследовании с участием 1 387 больных, поступивших в приемное отделение с неста бильной стенокардией, риск больничных осложнений (инфаркта миокарда, тяжелой стенокардии и смерти) повышался пропорционально классу стенокардии. В классе IA по Ризику он составил 2,7%, а в классе IV — 42,8%.
Шкала риска TIMI
Шкала TIMI основана на исследованиях TIMI IIВ и ESSENCE. Она учитывает возраст, клиническую картину, изменения ЭКГ и повышение уровня маркеров некроза миокарда.
| Баллы (каждый фактор риска добавляет один балл, максимум 7 баллов) | |
|---|---|
| Возраст > 65 лет | |
| Наличие трех и более факторов риска атеросклероза | |
| Ранее выявленный стеноз коронарной артерии более 50% диаметра | |
| Подъем или депрессия сегмента ST на ЭКГ при поступлении | |
| Два и более приступа стенокардии за последние 24 ч | |
| Прием аспирина в течение последних 7 сут | |
| Повышение маркеров некроза миокарда | |
| Число баллов | Риск смерти или инфаркта миокарда в ближайшие 2 нед, % |
| 0-1 | 4,7 |
| 2 | 8,3 |
| 3 | 13,2 |
| 4 | 19,9 |
| 5 | 26,2 |
| 6-7 | 40,9 |
Высокий балл по шкале TIMI говорит о высоком риске смерти, инфаркта миокарда и повторной ишемии, требующей реваскуляризации.
Шкала риска GUSTO
В исследованиях PURSUIT и GUSTO IV—ACS были выявлены дополнительные факторы риска. Все эти классификации позволяют оценить риск и на этом основании выбрать тактику лечения. Б. Эпидемиология. Инфаркт миокарда без подъема сегмента ST по сравнению с инфарктом миокарда с подъемом сегмента ST случается в среднем в более пожилом возрасте, и ему сопутствует больше факторов риска, таких, как сахарный диабет, артериальная гипертония и гиперлипопротеидемия. Кроме того, инфаркт миокарда без подъема сегмента ST чаще случается у больных, уже перенесших инфаркт, и после реваскуляризации. В. Клинические проявления. Для нестабильной стенокардии характерна боль в груди в покое или при минимальной физической нагрузке, другой вариант — впервые возникшая или прогрессирующая стенокардия напряжения (прогрессирование может выражаться в усилении или учащении приступов боли и их возникновении при меньших, чем ранее, физических нагрузках). По сравнению со стенокардией напряжения боль в груди при нестабильной стенокардии обычно бывает более тяжелой и продолжительной, нередко проходит только после нескольких доз нитроглицерина под язык или продолжительного пребывания в покое. Отличить инфаркт миокарда без подъема сегмента ST от нестабильной стенокардии по клинической картине и ЭКГ невозможно. Дифференцировать их можно только по уровню маркеров некроза миокарда.
| Баллы | |
|---|---|
| Возраст | |
| 50-59 | 2 |
| 60-69 | 4 |
| 70-79 | 6 |
| 80 и старше | 8 |
| Анамнез | |
| Сердечная недостаточность | 2 |
| Инсульты, преходящая ишемия мозга | 2 |
| Инфаркты миокарда, реваскуляризация, стабильная стенокардия | 1 |
| Симптомы и лабораторные параметры | |
| ЧСС более 90 мин-1 | 3 |
| Повышение уровня тропонина или МВ-фракции КФК | 3 |
| Креатинин > 1,4 мг% | 2 |
| С-реактивный белок > 20 мг/л | 2 |
| С-реактивный белок 10-20 мг/л | 1 |
| Анемия | 1 |
| Сумма баллов | 30-дневная смертность |
| 0-5 | 0,4 |
| 6-10 | 2,8 |
| 11-15 | 8,7 |
| 16-19 | 25,0 |
| 20-22 | 41,7 |
Патогенез острого коронарного синдрома
В основе острого коронарного синдрома лежат такие взаимосвязанные процессы, как разрыв бляшки, активация и агрегация тромбоцитов с образованием тромба, дисфункция эндотелия, спазм и перестройка сосудов.
Разрыв бляшки
Разрыв бляшки лежит в основе нестабильной стенокардии и инфаркта миокарда (как с подъемом, так и без подъема сегмента ST). На поврежденной бляшке оседают тромбоциты, происходит их активация и агрегация, активируется система свертывания и образуется тромб. Разрыву бляшки способствует воспаление, в том числе активация лимфоцитов и макрофагов. Возможно, определенную роль играет инфекция, вызванная Chlamydia pneumoniae. Поврежденные бляшки даже после стабилизации растут быстрее других. При контрольной ангиографии у 85 больных с нестабильной стенокардией, лечившихся только медикаментозно, было выявлено увеличение в размерах (вплоть до окклюзии) 25% поврежденных бляшек и лишь 7% неповрежденных бляшек. При этом рост бляшек коррелировал с частотой ишемических осложнений.
Тромбоз
Контакт тромбоцитов с субэндотелием приводит к их адгезии, агрегации и, в конце концов, к образованию тромба. При активации тромбоцитов происходит изменение конформации гликопротеида IIb/IIIa на их мембране, что ведет к дальнейшей активации и агрегации тромбоцитов. При этом, заметно ускоряется образование тромбина, что влечет за собой дальнейший рост и стабилизацию тромба.
Спазм сосудов
Спазм сосудов может возникать под действием местных медиаторов, высвобождающихся из субэндотелия или растущего тромба, а может быть первичным. Сам по себе первичный спазм коронарной артерии может вызывать острый коронарный синдром, например вазоспастическую стенокардию (стенокардию Принцметала). Спазм нередко возникает в области нестабильной бляшки, что, как считается, может способствовать тромбозу. Эндотелиальная дисфункция и спазм могут возникать даже при ангиографически неизмененных коронарных артериях.
Множественное поражение коронарных артерий
Обычно при нестабильной стенокардии и инфаркте миокарда без подъема сегмента ST на коронарной ангиограмме обнаруживается единственное поражение, вызвавшее инфаркт, однако нередко таких поражений бывает несколько, что указывает на системный характер заболевания. В рамках исследования VANQWISH у 14% больных с инфарктом миокарда без подъема сегмента ST было выявлено несколько осложненных стенозов и острых окклюзии, тогда как только одно поражение было всего у 49% больных. В другой работе с помощью интракоронарного УЗИ при инфаркте миокарда в 79% случаев разрывы бляшек обнаруживались вне поражения, вызвавшего инфаркт. В среднем у одного больного оказалось по 2,1 разрыва бляшки.
Вторичная стенокардия
При неосложненных бляшках стенокардия покоя может возникать из-за повышения потребности миокарда в кислороде (при тахикардии, тяжелой артериальной гипертензии, употреблении кокаина, тиреотоксикозе, лихорадке, сепсисе) и снижения его доставки (при анемии, гипоксии).
Диагностика
Диагноз нестабильной стенокардии ставят прежде всего по клинической картине. Предварительный диагноз помогают подтвердить или опровергнуть дополнительные методы исследования: ЭКГ, маркеры некроза миокарда, ЭхоКГ, коронарная ангиография. У больных с низким риском осложнений обычно ограничиваются неинвазивными исследованиями. Некоторые рекомендуют проводить раннюю коронарную ангиографию всем больным независимо от риска, преимущества такого подхода обсуждаются ниже. В любом случае, при высоком риске осложнений она показана.
Следует исключить другие состояния, вызывающие боль в груди, — реберный хондрит, пневмонию и перикардит, а также такие опасные заболевания, как расслаивающая аневризма аорты, пневмоторакс и ТЭЛА. Кроме того, необходимо помнить о заболеваниях, провоцирующих ишемию миокарда: гипертонических кризах, тиреотоксикозе, сепсисе и других.
Физикальное исследование играет второстепенную роль в диагностике нестабильной стенокардии. Оно позволяет выявить признаки сердечной недостаточности (набухание шейных вен, III тон сердца), нарушение податливости левого желудочка (IV тон) и поражение периферических сосудов (сосудистые шумы). Все эти симптомы указывают на высокую вероятность тяжелого поражения коронарных артерий.
ЭКГ
При нестабильной стенокардии и инфаркте миокарда без подъема сегмента ST на ЭКГ часто обнаруживается депрессия или преходящий подъем сегмента ST и инверсия зубцов Т. Однако примерно у 20% больных с повышением маркеров некроза миокарда изменений ЭКГ нет. Нормальная ЭКГ не позволяет исключить острый коронарный синдром у больных с болью в груди.
При подъеме сегмента ST более 1 мм в двух или более смежных отведениях или впервые выявленной блокаде левой ножки пучка Гиса необходима экстренная реперфузия . Отрицательные зубцы Т — наименее специфичный ЭКГ-признак острого коронарного синдрома. Однако появление отрицательных симметричных зубцов Т глубже 2 мм в нескольких грудных отведениях в сочетании с болью в груди — признак острой ишемии, обычно вызванной стенозом передней нисходящей артерии. При такой картине реваскуляризация нередко улучшает систолическую функцию левого желудочка, а изменения ЭКГ исчезают.
Раньше инфаркт миокарда без подъема сегмента ST называли инфарктом миокарда без патологических зубцов Q или нетрансмуральным инфарктом миокарда, потому что некроз миокарда при этом не сопровождается ЭКГ-признаками трансмурального повреждения. Поскольку на самом деле подъем сегмента ST плохо соотносится с объемом поражения миокарда, термин «инфаркт миокарда без подъема сегмента ST» более корректен.
В исследовании TIMI III среди 1 473 больных с нестабильной стенокардией и инфарктом миокарда без подъема сегмента ST преходящий подъем сегмента ST отмечался у 10% больных, депрессия сегмента ST — у 33%, инверсия зубцов Т — у 46%, отсутствие ишемических изменений ЭКГ — у 9%.
Маркеры некроза миокарда
Креатинфосфокиназа (КФК)
При подозрении на инфаркт миокарда чаще всего определяют КФК и ее МВ-фракцию. Их активность в первые сутки измеряют каждые 6—8 ч. Пик активности общей КФК приходится на 12—24 ч, а МВ-фракции КФК — на 10— 18 ч после появления жалоб. МВ-фракция КФК — более чувствительный и специфичный маркер некроза миокарда, чем общая КФК. Незначительная активность КФК и ее МВ-фракции определяется даже у здоровых людей, но превышение нормальных значений указывает на некроз миокарда. Активность КФК и, реже, ее МВ-фракции может повышаться не только при инфаркте миокарда, но и при многих других состояниях, например при перикардите, повреждении скелетных мышц и почечной недостаточности.
Тропонины
Сердечные тропонины — это сократительные белки, которые имеются только в кардиомиоцитах. В отличие от КФК и МВ-фракции КФК, источником которых может быть не только миокард, любое повышение сердечных тропонинов указывает на повреждение миокарда. Во многих клинических испытаниях уровень сердечных тропонинов использовался в качестве диагностического критерия и для предсказания исхода при остром коронарном синдроме. Уровень тропонинов Т и I в сыворотке повышается в течение 3—12 ч после некроза миокарда и остается повышенным намного дольше, чем КФК, — 10—14 дней. Прямого соответствия между уровнем тропонинов и размерами инфаркта, однако, нет. Повышение сердечных тропонинов — более чувствительный признак инфаркта миокарда, чем повышение МВ-фракции КФК. Кроме того, повышение тропонинов — независимый неблагоприятный прогностический фактор. В исследовании GUSTO IIb 30-дневная смертность больных нестабильной стенокардией составила 11,8% при повышении уровня сердечного тропонина Т (> 0,1 нг/мл) против 3,9% при нормальном его уровне
Поскольку повышение уровня сердечных тропонинов — наиболее чувствительный и специфичный маркер некроза миокарда, обладающий к тому же и самостоятельным прогностическим значением, его надо определять всем больным с острым коронарным синдромом. Кроме того, для полноты картины надо определять активность КФК и ее МВ-фракции В.
Другие биохимические маркеры
С-реактивный белок
В исследовании TIMI IIА повышение уровня С-реактивного белка (> 1,55 мг%) у больных с нестабильной стенокардией и инфарктом миокарда без подъема сегмента ST сопровождалось повышенной смертностью, даже при отрицательной пробе на тропонин Т (5,80% против 0,36%, р = 0,006). Наибольшая смертность была при одновременном повышении уровней С-реактивного белка и тропонина Т, при повышении одного из этих показателей смертность была промежуточной, а при нормальных значениях того и другого она была самой низкой (9,10%, 4,65% и 0,36% соответственно, р = 0,0003).
Другие показатели
Фибриноген отражает степень активации свертывающей системы, а интерлейкин-6 и сывороточный амилоид А говорят об активности воспаления, повышение этих показателей тоже может свидетельствовать о повышенном риске у больных с острым коронарным синдромом без подъема сегмента ST. В настоящее время изучается прогностическое значение факторов роста (например, фактора роста эндотелия и основного фактора роста фибробластов) и свободных молекул адгезии (например, ICAM-1, Р-селектина и Е-селектина).
ЭхоКГ
При остром коронарном синдроме нарушения локальной сократимости миокарда могут указывать на острую ишемию. Однако при небольшой ишемии нарушений локальной сократимости при ЭхоКГ может не быть. Кроме того, нарушения сократимости могут появляться только во время ишемии. Отличить новые нарушения сократимости от старых при ЭхоКГ невозможно. При ИБС в анамнезе или ранее имевшейся систолической дисфункции диагностическое значение ЭхоКГ снижается. Это усугубляется еще тем, что не всегда можно получить хорошее изображение и в нужный момент может не оказаться опытного техника (сонографиста). ЭхоКГ при остром коронарном синдроме используют в основном не для диагностики, а для оценки функции левого желудочка, особенно при признаках сердечной недостаточности.
Неинвазивные методы исследования
Раньше считалось, что нагрузочные пробы больным с нестабильной стенокардией противопоказаны из-за опасности острой окклюзии коронарной артерии при увеличении нагрузки на сердце в присутствии нестабильной бляшки. Однако при низком риске осложнений нагрузочные пробы не противопоказаны. В основном их проводят тем, у кого нет боли в течение 24—48 ч, нет повышения уровня маркеров некроза миокарда, нет четких признаков ишемии на ЭКГ и имеется малое число факторов риска атеросклероза.
При положительных результатах нагрузочной пробы с 201Тl показана коронарная ангиография, поскольку у таких больных повышен риск осложнений. Если же сцинтиграфия миокарда с 201Тl не выявляет стойких или обратимых дефектов накопления, больного можно выписать и лечить амбулаторно.
При невозможности выполнения пробы с физической нагрузкой проводят фармакологические пробы с добутамином или дипиридамолом. Однако эти пробы у больных с острым коронарным синдромом в крупных исследованиях не изучались.
Коронарная ангиография
При нестабильной стенокардии у 10—20% больных обнаруживаются неизмененные коронарные артерии или незначимые стенозы (< 50% диаметра), у 30—35% — поражение одного сосуда, у 25—30% — двух сосудов, у 20—25% — трех сосудов, у 5—10% — поражение ствола левой коронарной артерии.
Тактика
Если коронарная ангиография не проводилась, обязательно проводят нагрузочную пробу. При появлении обратимых дефектов накопления или нарушений локальной сократимости при проведении нагрузочных проб показана коронарная ангиография.
Проведение коронарной ангиографии всем больным с нестабильной стенокардией оправдано, однако заведомо нужна она только больным высокого риска.
Показания к коронарной ангиографии при нестабильной стенокардии
| Коронарная ангиопластика или шунтирование в прошлом |
| Сердечная недостаточность |
| Систолическая дисфункция левого желудочка (фракция выброса < 50%) |
| Угрожающие жизни желудочковые аритмии |
| Продолжающаяся или рецидивирующая ишемия |
| Признаки обширной ишемии по данным неинвазивных исследований |
| Признаки обширной ишемии по данным неинвазивных исследований |
| Значимое поражение клапанов (митральная недостаточность, аортальный стеноз) |
При наличии этих показаний ранняя коронарная ангиография рекомендуется независимо от эффективности медикаментозного лечения.
Остальных больных можно лечить исключительно медикаментозно.
Лечение
Используют средства, препятствующие агрегации и активации тромбоцитов, антикоагулянты , а также антиангинальные средства. При сохранении боли, несмотря на терапию высокими дозами, срочно проводят коронарную ангиографию и ангиопластику. При стабилизации состояния на фоне медикаментозного лечения коронарную ангиографию можно провести позже. При коронарной ангиографии окклюзии обычно не обнаруживается.
Цель коронарной ангиопластики при нестабильной стенокардии и инфаркте миокарда без подъема сегмента ST — не экстренная реперфузия (как при инфаркте миокарда с подъемом сегмента ST), а профилактика осложнений (смерти, инфаркта миокарда и повторной ишемии).
Медикаментозное лечение (в порядке значимости)
- Антиагреганты: аспирин и, возможно, клопидогрел.
- Антиангинальные средства: нитраты и бета-адреноблокаторы.
- Антикоагулянты: нефракционированный или низкомолекулярный гепарин.
- Блокаторы гликопротеида IIb/IIIa, если планируется коронарная ангиопластика.
Антиагреганты
Аспирин
Несмотря на то что аспирин — довольно слабый антиагрегант, он весьма заметно снижает смертность при нестабильной стенокардии. Существует несколько путей активации тромбоцитов, и аспирин блокирует только один из них — связанный с образованием тромбоксана А2 под действием циклооксигеназы. Эффективность аспирина в дозах от 75 до 325 мг/сут при остром коронарном синдроме без подъема сегмента ST была доказана в пяти крупных исследованиях. В среднем он снижал смертность и число инфарктов миокарда на 50%.
Аспирин начинает действовать быстро, уже через 15 мин он значительно подавляет синтез тромбоксана А2, а снижение агрегации тромбоцитов определяется уже через 60 мин Аспирин дают как можно скорее. Поскольку аспирин ингибирует циклооксигеназу необратимо, его антиагрегантное действие сохраняется в течение 7-10 дней.
В отсутствие противопоказаний (продолжающееся кровотечение, доказанная аллергия к аспирину) всем больным с подозрением на острый коронарный синдром дают разжевать и проглотить аспирин в дозе 325 мг. Затем дозу можно уменьшить до 81—162 мг/сут.
Тиенопиридины (тиклопидин и клопидогрель)
Тиенопиридины препятствуют агрегации тромбоцитов за счет блокады рецепторов АДФ. Тиклопидин уменьшает смертность и число инфарктов миокарда в течение 6 мес. у больных с нестабильной стенокардией примерно в той же степени, что и аспирин. В исследовании CURE добавление клопидогреля к аспирину при остром коронарном синдроме без подъема сегмента ST снижало сердечно-сосудистую смертность, число инфарктов миокарда и инсультов по сравнению с аспирином (9,3% против 11,4%, р < 0,001) У больных, получавших оба препарата, реже возникала рефрактерная стенокардия, сердечная недостаточность, им реже требовалась реваскуляризация. Однако при этом повышался риск кровотечений (3,7% против 2,7%), в основном за счет больных, которым проводилось коронарное шунтирование
Проведенное в рамках CURE исследование PCI-CURE показало, что добавление клопидогреля перед коронарной ангиопластикой уменьшает сердечно-сосудистую смертность, число инфарктов и необходимость в срочной реваскуляризации в ближайший месяц (4,5% против 6,4%) Длительное лечение клопидогрелем уменьшало сердечно-сосудистую смертность, число инфарктов миокарда и необходимость в реваскуляризации без значимого влияния на риск кровотечения.
Действие тиклопидина достигает максимума через 2—3 сут. Клопидогрел действует быстрее, антиагрегантное действие начинается уже через 2 ч после приема насыщающей дозы (300 мг).
Тиклопидин может вызвать нейтропению (у 1—5% больных) и редко — тромботическую тромбоцитопеническую пурпуру Описаны случаи тромботической тромбоцитопенической пурпуры на фоне лечения клопидогрелем.
Тиклопидин дается в насыщающей дозе 500 мг, затем по 250 мг 2 раза в сутки. Клопидогрел дают в дозе 300 мг, затем по 75 мг 1 раз в сутки.
Клопидогрел лучше тиклопидина, поскольку начинает действовать быстрее, его принимают один раз вдень и у него меньше побочных эффектов. Назначая клопидогрел, следует помнить о высоком риске кровотечений при коронарном шунтировании. Если коронарное шунтирование не планируется, клопидогрел начинают давать одновременно с аспирином. Перед коронарным шунтированием клопидогрел отменяют не менее чем за 5 дней, лучше — за неделю. Это снижает риск осложнений, в том числе кровотечений и повторных операций. Если планируется коронарная ангиография, с клопидогрелем имеет смысл подождать до ее проведения и решения вопроса о способе реваскуляризации.
Антикоагулянты
Гепарин
Нефракционированный гепарин в сочетании с аспирином снижает частоту ишемических осложнений у больных с нестабильной стенокардией. Метаанализ шести исследований показал, что нефракционированный гепарин с аспирином снижает смертность и число инфарктов миокарда на 33% по сравнению с одним аспирином, хотя этот результат не достиг статистической достоверности. Кроме того, польза гепарина может нивелироваться после его отмены. Расчет и коррекцию доз гепарина в зависимости от АЧТВ облегчают специальные номограммы.
| АЧТВ, с | Скорость инфузии |
|---|---|
| Начало лечения | 80 ед/кг в/в струйно, затем 18 ед/кг/ч |
| < 35 (менее чем в 1,2 раза выше контрольного значения) | 80 ед/кг в/в струйно, затем увеличить скорость инфузии на 4 ед/кг/ч |
| 35—45 (в 1,2—1,5 раза выше контрольного значения) | 40 ед/кг в/в струйно, затем увеличить скорость инфузии на 2 ед/кг/ч |
| 46—70 (в 1,5—2,3 раза выше контрольного значения) | Коррекция не требуется |
| 71—90 (в 2,3—3 раза выше контрольного значения) | Уменьшить скорость инфузии на 2 ед/кг/ч |
| > 90 (более чем в 3 раза выше контрольного значения) | Прекратить инфузию на 1 ч, затем возобновить, уменьшив скорость на 3 ед/кг/ч |
Оптимальная продолжительность лечения гепарином неизвестна, однако, по данным некоторых исследований, эффект достигается при лечении как минимум в течение 3—7 сут.
Рикошетная ишемия
При нестабильной стенокардии в/в инфузию гепарина проводят всем больным с высоким и умеренным риском в отсутствие противопоказаний (продолжающееся кровотечение, аллергия к гепарину, гепариновая тромбоцитопения в анамнезе).
Сначала гепарин вводят струйно в дозе 60 ед/кг, затем переходят на инфузию со скоростью 15 ед/кг/ч. Каждые 6 ч определяют АЧТВ, пока оно не установится в пределах 50—70 с; после этого можно определять АЧТВ каждые 12—24 ч.
Низкомолекулярный гепарин
К преимуществам низкомолекулярного гепарина перед нефракционированным относятся более высокая биодоступность, фиксированные дозы, более сильное ингибирование тромбина, меньший риск гепариновой тромбоцитопении и меньшая стоимость лечения за счет того, что не нужно следить за АЧТВ.
Прямые ингибиторы тромбина
Прямые ингибиторы тромбина более активно ингибируют тромбин, чем гепарин, и не инактивируются белками плазмы и тромбоцитарным фактором 4. Однако в настоящее время единственным общепринятым показанием к их назначению вместо гепарина служит гепариновая тромбоцитопения.
Гирудин
Гирудин - прямой ингибитор тромбина, изначально полученный из пиявок. В исследовании GUSTO IIb гирудин сравнивали с гепарином у 12 142 больных с острым коронарным синдромом; гирудин снижал смертность и число инфарктов миокарда в течение 24 ч (1,3% против 2,1%, р = 0,001) Однако через 30 дней преимущество гирудина уменьшилось и стало статистически незначимым (8,9% против 9,8%, р = 0,06). Преимущество отмечалось в основном за счет инфарктов миокарда.
В исследовании OASIS-2 отмечалась тенденция к снижению смертности и числа инфарктов миокарда в течение 7 дней у больных с острым коронарным синдромом без подъема сегмента ST, получавших гирудин вместо гепарина (3,6% против 4,2%, р = 0,077) Смертность, частота инфарктов миокарда и рефрактерной стенокардии в течение 7 дней уменышалась с 6,7 до 5,6% (р = 0,0125). Однако при этом на фоне гирудина было больше тяжелых кровотечений (1,2% против 0,7%, р = 0,01).
Бивалирудин
Бивалирудин, производное гирудина более короткого действия, был утвержден ФДА для лечения больных с нестабильной стенокардией, которым проводится коронарная ангиопластика. При лечении этих больных бивалирудином вместо гепарина отмечается тенденция к улучшению результатов коронарной ангиопластики. Прямые ингибиторы тромбина не входят в стандартное лечение острого коронарного синдрома без подъема сегмента ST, но при особых обстоятельствах, например при гепариновой тромбоцитопении, они могут быть полезны.
Фондапаринукс
Фондапаринукс, аналог содержащегося в гепарине пентасахарида, избирательно ингибирует фактор Ха. В настоящее время он проходит клинические исследования, в том числе после операций на костях и суставах для профилактики тромбоза глубоких вен ног и при нестабильной стенокардии.
Низкомолекулярный или нефракционированный гепарин?
В предыдущих рекомендациях по лечению пациентов с нестабильной стенокардией и инфарктом миокарда без подъема сегмента ST нефракционированный гепарин был признан средством выбора при проведении антитромбиновой терапии. Впрочем, доказательства эффективности нефракционированного гепарина менее убедительны, чем других стратегий лечения.
В клинической практике поддержание терапевтического протромбинового контроля затруднено в связи с непрогнозируемым связыванием гепарина с протеинами плазмы крови. Кроме того, гепарин характеризуется ограниченной эффективностью в случаях, когда тромбин связан со сгустками, богатыми тромбоцитами.
Недостатки нефракционированного гепарина
- Гепарин связывается с белками плазмы крови, адсорбируется на поверхности эндотелиальных клеток, фагоцитируется макрофагами — утрата биологической активности вводимого гепарина и плохая предсказуемость антикоагулянтного эффекта у конкретного больного
- При назначении гепарина с лечебной целью необходим тщательный индивидуальный лабораторный контроль. В одном из крупных исследований TIMI 9B установлено, что во время внутривенного введения гепарина АЧТВ находилось в пределах терапевтических значений только около 30% всего времени в течение суток
- Практически сложно обеспечить как минимум 48 (лучше 72)-часовую непрерывную внутривенную инфузию препарата
- Тромбоцитарный фактор IV способен инактивировать гепарин, помимо этого тромбоциты способны связывать фактор Xa и таким образом защищать его от действия гепарина
- Гепарин ввиду больших размеров своей молекулы не способен инактивировать тромбин, связанный с фибрином и субэндотелиальными структурами, таким образом гепарин не может активно противодействовать фибринообразованию в месте разрыва бляшки
- Гепарин способен усиливать агрегацию тромбоцитов под влиянием различных индукторов, кроме тромбина
- Показано, что при нестабильной стенокардии применение гепарина с поддержанием АЧТВ в 2 раза выше контроля сопровождается быстрым снижением уровня фибринопептида А, однако снижения уровня фрагмента протромбина 1+2 (F1+2) не происходит. Таким образом, снижая активность тромбина, гепарин не влияет на его образование и риск развития тромбоза во время терапии гепарином сохраняется
- Действие гепарина продолжается только в течение его непрерывной внутривенной инфузии, более того, после прекращения гепаринотерапии отмечают реактивацию тромботического процесса с возможным развитием инфаркта миокарда
- Частота иммунной тромбоцитопении на фоне введения гепарина составляет 1–3%, ее возникновение связано с появлением антител к гепарину и компонентам мембраны тромбоцитов, которые активируют тромбоциты и вызывают распространенный тромбоз микрососудов, сама тромбоцитопения носит вторичный характер и образуется в результате потребления тромбоцитов в образующихся тромбах
При отсутствии ацетилсалициловой кислоты лечение гепарином связано с более низкой частотой возникновения рефрактерной стенокардии, инфаркта миокарда и смерти по сравнению с плацебо (снижение риска на 29%), тогда как ацетилсалициловая кислота снижает риск по сравнению с плацебо на 56%. Комбинация ацетилсалициловой кислоты и гепарина не имела достоверно большего защитного эффекта, чем ацетилсалициловая кислота в качестве монотерапии. Начальный защитный эффект гепарина терялся после прекращения терапии (феномен рикошета). Соответственно не было доказательств стойкого защитного эффекта гепарина.По данным метаанализа эффектов гепарина в дополнение к терапии ацетилсалициловой кислотой у пациентов с нестабильной стенокардией (6 рандомизированных исследований) частота смерти или инфаркта миокарда в группе ацетилсалициловая кислота + гепарин составляла 7,9%, в группе монотерапии ацетилсалициловой кислотой — 10,3% (абсолютное снижение риска на 2,4%; соотношение риска 0,74 (95% доверительные интервалы (ДИ) 0,5–1,09); p=0,10 (уровень доказательности В).
Эти результаты не позволяют уверенно говорить о целесообразности назначения гепарина в дополнение к ацетилсалициловой кислоте. Впрочем, большие по объему исследования до настоящего времени не проводились. Несмотря на это, в клинических руководствах рекомендуют применять стратегию одновременного применения
нефракционированного гепарина и ацетилсалициловой кислоты, что можно расценивать как прагматическую экстраполяцию существующих доказательств.
По сравнению с нефракционированным гепарином низкомолекулярные гепарины характеризуются усиленной активностью против фактора Ха, сравнительно с активностью против фактора анти-IIа (антитромбиновая активность). Кроме того, низкомолекулярные гепарины менее чувствительны к тромбоцитарному фактору 4 и имеют более прогнозированный антикоагулянтный эффект с меньшей вероятностью возникновения тромбоцитопении.
Преимущества низкомолекулярного гепарина
- Значительно лучшая по сравнению с обычным гепарином прогнозируемость антитромботического эффекта ввиду отсутствия связывания с белками плазмы крови и мембранами эндотелиоцитов, соответственно терапия низкомолекулярными гепаринами не требует столь тщательного индивидуального лабораторного контроля
- Более высокая биодоступность (до 90% после глубокой подкожной инъекции) низкомолекулярных гепаринов, что позволяет назначать их подкожно не только с профилактической, но и лечебной целью
- Более продолжительная антитромботическая активность (период полувыведения >4,5 ч после внутривенного введения против 50–60 мин у обычного гепарина) с возможностью назначения 1–2 раза в сутки.
Данные клинических исследований
Эти препараты можно назначать подкожно, исходя из дозы, которая зависит от массы тела пациента; при этом не требуется лабораторный контроль. Различные низкомолекулярные гепарины характеризуются сходной активностью в предотвращении и лечении венозного тромбоза, несмотря на некоторые отличия в фармакологии и пе-
риоде полувыведения. В нескольких клинических исследованиях, проведенных в последнее время, сравнивали эффективность низкомолекулярных гепаринов с плацебо или с нефракционированным гепарином.
В исследовании FRISC доказали пользу применения далтепарина по сравнению с плацебо у пациентов с нестабильной стенокардией или инфарктом миокарда без подъема сегмента ST, которые получали фоновую терапию ацетилсалициловой кислотой, а также целесообразность назначения такого лечения на протяжении длительного периода. В 4 рандомизированных исследованиях сравнивали эффективность различных низкомолекулярных гепаринов и нефракционированного гепарина.
Результаты метаанализа 4 исследований не позволили получить убедительные доказательства отличия безопасности и эффективности между низкомолекулярными гепаринами и нефракционированным гепарином. Метаанализ свидетельствовал о том, что продолжительное применение низкомолекулярных гепаринов ассоциировалось с повышением риска больших кровотечений (соотношение риска 2,26; 95% ДИ 1,63–3,41; p<0,0001).
Тем не менее, результаты дальнейших исследований изменили точку зрения на эффективность низкомолекулярных гепаринов. Существуют убедительные доказательства того, что у пациентов, которые получают ацетилсалициловую кислоту, низкомолекулярные гепарины более эффективны по сравнению с плацебо (уровень доказательности А). В 2 исследованиях получены данные в пользу низкомолекулярного гепарина (эноксапарина) сравнительно с нефракционированным гепарином при применении в начале лечения.
Поскольку у больных, которым вводят низкомолекулярные гепарины, трудно определить уровень активности антикоагулянта (например определить АЧТВ), то кардиологи отделений интенсивной терапии выражают опасения по поводу замены нефракционированного гепарина низкомолекулярным для больных, которым планируется проведение катетеризации с возможным перкутанным коронарным вмешательством.
В исследовании NIСЕ-1 внутривенное введение эноксапарина (1,0 мг/кг массы тела) осуществляли у 828 больных с последующим наблюдением после элективной ангиопластики без внутривенного введения ингибитора гликопротеиновых рецепторов IIb/IIIа. Частота кровотече ний (1,1% для больших кровотечений и 6,2% — для малых через 30 дней была сопоставима с частотой, выявленной в предыдущих исследованиях, в которых пациентам вводили нефракционированный гепарин.
Как уже указывалось, сравнение низкомолекулярных гепаринов с нефракционированным гепарином проводили в 4 крупных рандомизированных исследованиях. 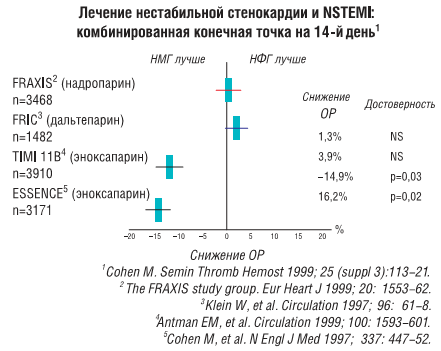
NSTEMI — инфаркт миокарда без подъема сегмента ST; НМГ — низкомолекулярные гепарины; НФГ — нефракционированный гепарин; ОР — относительный риск; NS — отсутствие статистически достоверных отличий; FRAXIS — Fraxiparine in Ischemic Syndrome; FRIC — Fragmin in Unstable Coronary Artery Disease; ESSENCE — Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q wave Coronary Events
В исследовании FRIC (фрагмин при нестабильной ИБС) 1 482 больным с нестабильной стенокардией или инфарктом миокарда без подъема сегмента SТ вводили далтепарин (120 МЕ/кг подкожно 2 раза в сутки) или нефракционированный гепарин в течение 6 дней. С 6-го по 45-й день больные были опять рандомизированы по группам для введения далтепарина (двойная слепая фаза) (120 МЕ/КГ 1 раз в сутки) или плацебо. В течение первого этапа исследования риск смерти, развития инфаркта миокарда или возвратной стенокардии был недостоверно выше при применении далтепарина (9,3% по сравнению с 7,65%; р=0,33), а риск смерти или развития инфаркта миокарда не изменялся (3,9% по сравнению с 3,6%; р=0,8). Частота летального исхода при применении далтепарина также была несколько выше (1,5% по сравнению с 0,4% при введении нефракционированного гепарина; р=0,057). В период с 6-го по 45-й день частота летального исхода, развития инфаркта миокарда или возвратной стенокардии была сопоставимой в группах применения препарата и плацебо.
В исследовании ЕSSENCЕ эноксапарин (1 мг/кг 2 раза в сутки подкожно) сравнивали со стандартным нефракционированным гепарином (5 000 ЕД болюсно) с последующей инфузией при коррекции дозы по величине АЧТВ в пределах от 55 до 86 с и введением в течение от 48 ч до 8 дней (средняя продолжительность в обеих группах — 2,6 дня). При применении нефракционированного гепарина необходимая величина АЧТВ достигалась в период от 12 до 24 ч только у 46% больных. Комплексный показатель, включающий смертность, развитие инфаркта миокарда или возвратной стенокардии, снижался при применении эноксапарина на 16,2% через 14 дней (19,8% для нефракционированного гепарина по сравнению с 16,6% для эноксапарина; р=0,019) и на 19% через 30 дней (23,3% против 19,8%; р=0,017). Смертность не изменялась, а для частоты летального исхода и развития инфаркта миокарда отмечали тенденцию к снижению на 29% (р=0,06) через 14 дней и на 26% (р=0,08) через 30 дней.
В исследовании ТIМI IIВ 3 910 больных с нестабильной стенокардией и инфарктом миокарда без подъема ST рандомизированы по группам введения эноксапарина (30 мг внутривенные болюсные инъекции, затем по 1 мг/кг подкожно через каждые 12 ч) или нефракционированного гепарина (болюсная инъекция 70 ЕД/кг, затем инфузия — 15 ЕД/кг/ч с коррекцией дозы по величине АЧТВ до достижения величины АЧТВ, превышающей в 1,5–2,5 раза контрольную). После терапии больных переводили на амбулаторное лечение, во время которого тем, кому ранее вводили нефракционированный гепарин, 2 раза в сутки назначали эноксапарин или плацебо. Эта стадия исследования была рандомизированной двойной слепой. Эноксапарин вводили в среднем 4,6 дня, а нефракционированный гепарин — 3 дня. Комплексный показатель, включавший смертность, частоту развития инфаркта миокарда и потребность в ургентной реваскуляризации (количество приступов возвратной стенокардии, требующее немедленного проведения коронарной реваскуляризации в период госпитализа ции или после выписки, что приводило к повторной госпитализации и проведению коронарной реваскуляризации), снижался на 8-е сутки с 14,5 до 12,4%; р=0,048; через 43 дня — с 19,6 до 17,3%; р=0,048. Смертность или частота развития инфаркта миокарда через 14 дней снижалась с 6,9 до 5,7%; р=0,114; через 43 дня — с 8,9 до 7,9%; р=0,276. Амбулаторное лечение не имело существенных преимуществ, более того, при амбулаторном лечении риск возникновения сильного кровотечения достоверно повышался. Применение эноксапарина как при стационарном, так и при амбулаторном лечении сопровождалось также повышением риска развития малых кровотечений.
Исследование FRAXIS включало три параллельные группы и было посвящено сравнению низкомолекулярного гепарина надропарина, вводимого в течение 6 или 14 дней, с нефракционированным гепарином, который применяли в качестве контроля. В исследование были включены 3 468 больных с нестабильной стенокардией и инфарктом миокарда без подъема ST. Комплексный показатель, включавший смертность, частоту развития инфаркта миокарда или рефрактерной стенокардии, составлял через 14 дней 18,1% в группе нефракционированного гепарина, 17,8% — в группе больных, которым вводили надропарин в течение 6 дней, и 20,0% — в группе лиц, леченных надропарином в течение 14 дней. Через 3 ме с этот показатель соответственно составлял 22,2; 22,3 и 26,2%; р<0,03 при сравнении данных в группе 14-дневного применения надропарина и в группе введения нефракционированного гепарина. У больных, леченных надропарином, во все периоды исследования отмечали тенденцию к повышению смертности и комплексного показателя, характеризующего смертность и частоту развития инфаркта миокарда.
Таким образом, в 2 исследованиях с эноксапарином продемонстрировано преимущество этого препарата по сравнению с нефракционированным гепарином, а в 2 исследованиях (одно с дальтепарином, второе — с надропарином) продемонстрировано нейтральное действие или выявлены неблагоприятные тенденции. Такие разнородные результаты можно объяснить целым рядом причин — различиями в группах больных, типе исследования, дозировках гепарина, свойствах различных низкомолекулярных гепаринов (разную молекулярную массу и соотношение антифактора Ха и антифактора IIа), а также другими неидентифицированными влияниями. При метаанализе результатов 2 исследований с эноксапарином с участием 7 081 больного выявлено статистически достоверное снижение (приблизительно на 20%) смертности, частоты развития инфаркта миокарда или потребности в срочной реваскуляризации на 2; 8; 14 и 43-й день и смертности или частоты развития инфаркта миокарда на 8; 14 и 43-й день. На 8; 14 и 43-й день отмечали также тенденцию к снижению смертности.
Несмотря на привлекательность сравнения относительных эффектов лечения с помощью различных низкомолекулярных гепаринов, следует признать ограниченность такого косвенного сравнения. Единственно надежным является непосредственное сравнение в ходе проведения хорошо спланированного клинического исследования или нескольких исследований. Сравнение различных терапевтических средств (например различные препараты низкомолекулярных гепаринов) со стандартным препаратом (например нефракционированным гепарином) в различных исследованиях не позволяет сделать вывод об относительной эффективности различных низкомолекулярных гепаринов, что
обусловлено вариабельностью оцениваемых параметров как в контрольной, так и экспериментальной группе вследствие различий в протоколах исследования, в сопутствующем лечении и т.д.Подобные соображения применимы и к сравнению действия ингибиторов тромбоцитарных гликопротеиновых рецепторов IIb/IIIа.
В исследованиях FRISC, FRIC, ТIMI IIВ, а также в FRISC II оценивали возможные преимущества продолжительного введения низкомолекулярных гепаринов после выписки из больницы. В первых 3 исследованиях не удалось продемонстрировать преимущества такого лечения после острой фазы заболевания. В исследовании FRISC с 6-го по 35-й или 45-й день вводили далтепарин в более низких дозах; в исследовании FRIC больных после первоначального 6-дневного лечения повторно рандомизировали по группам для дополнительного введения далтепарина в течение 40 дней.
В исследовании ТIMI IIВ период амбулаторного лечения составлял от 5 до 6 нед, а в иcследовании FRAXIS — 1 нед. Исследование FRISC II отличалось по своему типу: далтепарин вводили всем больным минимум 5 дней. Затем больные были рандомизированы по группам для введения плацебо или далтепарина 2 раза в сутки в течение 90 дней. При анализе результатов исследований выявлено значительное снижение в группе далтепарина комплексного показателя, включавшего смертность и частоту развития инфаркта миокарда, через 30 дней (3,1% по сравнению с 5,9%; р=0,002), но не через 3 мес (6,7% по сравнению с 8,0%; р=0,17). Показатель, характеризующий смертность, частоту развития инфаркта миокарда или частоту реваскуляризации в течение всего периода лечения, снизился через 3 мес (29,1% по сравнению с 33,4%; р=0,031). Преимущества продолжительного применения далтепарина проявлялись лишь у тех больных, которые отвечали на лечение и у которых в начале исследования был повышен уровень тропонина Т. Эти ре зультаты могут быть одним из показаний для длительного применения низкомолекулярных гепаринов у некоторых больных, которые поддаются лечению или у которых отложено проведение ангиографии.
Итак, вообще можно сделать вывод о том, что «острое» применение низкомолекулярных гепаринов по крайней мере не менее эффективно, чем нефракционированного гепарина (уровень доказательности А). Впрочем, эноксапарин имел преимущества сравнительно с нефракционированным гепарином в 2 исследованиях по прямым сравнениям препаратов (по комбинированной конечной точке — сумме случаев смерти, инфаркта миокарда и возвратной стенокардии).
Низкомолекулярные гепарины имеют важные практические преимущества, которые состоят в простоте применения, более стойком антитромбиновом эффекте, отсутствии потребности в мониторировании, а также в профиле безопасности применения, подобном нефракционированному гепарину. Результаты наблюдений позволяют предположить сходство профиля безопасности низкомолекулярных гепаринов и нефракционированного гепарина при применении вместе с ингибиторами гликопротеина IIb/IIIa (исследование NICE, 2000). Умеренное по объему исследование с участием 750 пациентов свидетельствует о лучшей эффективности и безопасности эноксапарина по сравнению с нефракционированным гепарином у пациентов, которые также получали эптифибатид. Впрочем, доказательства в пользу продолжительного амбулаторного применения низкомолекулярных гепаринов менее убедительны.
Блокаторы гликопротеида IIb/IIIa
Для агрегации тромбоцитов необходима активация на их поверхности гликопротеида IIb/IIIa. С активированным гликопротеидом IIb/IIIa связывается фибриноген, образующий межтромбоцитарные мостики, что ведет к формированию тромба. Блокада гликопротеида IIb/IIIa препятствует агрегации тромбоцитов и образованию тромба.
Блокаторы гликопротеида IIb/IIIa для в/в введения
Абциксимаб, представляющий собой Fab-фрагменты мышиных моноклональных антител к человеческому гликопротеиду IIb/IIIa, прочно связывается с этими гликопротеидами и подавляет агрегацию тромбоцитов в течение нескольких дней после введения препарата. Помимо гликопротеида IIb/IIIa абциксимаб блокирует некоторые другие рецепторы, в том числе рецепторы витронектина на клетках эндотелия и рецепторы МАС-I на лейкоцитах.
Эптифибатид представляет собой циклический пептид, полученный из змеиного яда. Он начинает действовать быстро и быстро выводится, поэтому для подавления агрегации тромбоцитов требуется его непрерывная инфузия.
Тирофибан и ламифибан — непептидные блокаторы гликопротеида IIb/IIIa, их Т1/2 составляет 4—6 ч.
Коронарная ангиопластика при нестабильной стенокардии
Абциксимаб и эптифибатид одобрены ФДА для применения при коронарной ангиопластике. Тирофибан одобрен для лечения нестабильной стенокардии; лечение тирофибаном продолжают при проведении коронарной ангиопластики.
Абциксимаб
Абциксимаб изучался в исследовании EPIC у 489 больных, которым проводили коронарную ангиопластику по поводу нестабильной стенокардии с высоким риском осложнений. Он уменьшал число тяжелых ишемических осложнений по сравнению с плацебо в течение 30 дней (4,8% против 12,8%, р = 0,012), в основном за счет уменьшения смертности и инфарктов миокарда. Этот эффект сохранялся при наблюдении в течение 3 лет.
В исследовании EPILOG абциксимаб при добавлении к гепарину значительно уменьшал число смертей, инфарктов миокарда и необходимость в срочной реваскуляризации в течение 30 дней после коронарной ангиопластики (11,7% против 5,2%, р < 0,001), причем он оказался эффективен и у больных с низким и со средним риском сердечно-сосудистых осложнений. В исследовании EPILOG гепарин вводился в небольших дозах, рассчитанных на массу тела, и риск кровотечения в группе абциксимаба и плацебо был примерно одинаков.
В исследовании CAPTURE абциксимаб, введенный за 18—24 ч до коронарной ангиопластики, уменьшал число смертей, инфарктов миокарда и необходимость в срочной реваскуляризации (10,8% против 15,4%, р = 0,017). Кроме того, у больных, получавших абциксимаб, чаще отмечалось рассасывание тромба и были лучше непосредственные результаты коронарной ангиопластики.
Исследование EPISTENT показало, что абциксимаб снижает риск ишемических осложнений и смертность в течение 1 года после ангиопластики (со стентированием).
Абциксимаб (0,25 мг/кг в/в струйно, затем 10 мкг/мин в течение 12 ч) обычно используется при коронарной ангиопластике по поводу острого коронарного синдрома.
Тирофибан
В исследовании RESTORE тирофибан сравнивали с плацебо при коронарной ангиопластике, проводимой в течение 72 ч после начала острого коронарного синдрома; все больные получали гепарин и аспирин. Тирофибан влиял на ближайший прогноз, уменьшая общий риск смерти, инфаркта миокарда, срочной рева-скуляризации из-за неудачной ангиопластики и повторной ишемии; при этом он не увеличивал число тяжелых кровотечений.
В исследовании PRISM тирофибан (0,6 мкг/кг/мин в течение 30 мин, затем 0,15 мкг/кг/мин) на 32% снижал риск смерти, инфаркта миокарда и тяжелой ишемии в течение 48 ч у больных с нестабильной стенокардией (3,8% против 5,6%, р = 0,01). Однако через 30 дней различия по этой комбинированной конечной точке нивелировались, хотя смертность оставалась ниже в группе тирофибана (2,3% против 3,6%). Следует отметить, что коронарная ангиопластика в этом исследовании проводилась лишь небольшому числу больных (1,9%).
В исследовании PRISM-PLUS тирофибан при добавлении к гепарину уменьшал риск смерти, инфаркта миокарда и рефрактерной ишемии в течение 7 дней (12,9% против 17,9%, р = 0,004), в течение 30 дней (18,5% против 22,3%, р = 0,03) и в течение 6 мес (27,7% против 32,1%, р = 0,02).
Эптифибатид
Эптифибатид изучался в исследовании PURSUIT. При остром коронарном синдроме без подъема сегмента ST эптифибатид (180 мкг/кг струйно, затем 1,3—2,0 мкг/кг/мин) уменьшал риск смерти и инфаркта миокарда в течение 30 дней (14,2% против 15,7%, р = 0,04), однако при этом возрастала частота кровотечений.
Медикаментозное лечение
Эптифибатид и тирофибан одобрены для лечения нестабильной стенокардии независимо оттого, проводится ли коронарная ангиопластика. Метаанализ исследований CAPTURE, PURSUIT и PRISM-PLUS показал, что блокаторы гликопротеида IIb/IIIa снижают риск смерти и инфаркта миокарда при остром коронарном синдроме без подъема сегмента ST на 34% еще во время инфузии препарата; это говорит о том, что эти средства могут быть эффективны не только за счет улучшения результатов коронарной ангиопластики. Однако в исследовании GUSTO IV—ACS введение абциксимаба в течение 24—48 ч при остром коронарном синдроме без подъема сегмента ST не уменьшало риск смерти и инфаркта миокарда в течение 30 дней по сравнению с обычным лечением аспирином и гепарином (8,2% при 24-часовом введении, 9,1% при 48-часовом введении и 8,0% при введении плацебо). Больные лечились преимущественно медикаментозно, коронарная ангиопластика в течение 48 ч проводилась лишь у 1,6% больных. Таким образом, по результатам этого исследования абциксимаб не улучшает прогноз больных, которым не планируется коронарная ангиопластика.
Согласно рекомендациям Американской коллегии кардиологов и Американской кардиологической ассоциации, блокаторы гликопротеида IIb/IIIa (тирофибан и эптифибатид, но не абциксимаб) в дополнение к аспирину и гепарину показаны при остром коронарном синдроме без подъема сегмента ST больным с высоким риском осложнений или с повторяющейся ишемией; их вводят в течение 48—72 ч либо до проведения коронарной ангиопластики. Эти средства оказывают положительное действие в основном в сочетании с коронарной ангиопластикой. У больных, которым коронарная ангиопластика не проводится, их эффективность остается спорной.
Блокаторы гликопротеида IIb/IIIa у разных групп больных
Повышение уровня сердечных тропонинов
В нескольких исследованиях было показано, что блокаторы гликопротеида IIb/IIIa эффективны прежде всего у больных с повышенным уровнем сердечных тропонинов. В исследовании CAPTURE абциксимаб снижал смертность и число инфарктов миокарда только у больных с повышенным уровнем тропонина Т (9,5% в группе абциксимаба против 23,9% в группе плацебо, тогда как при отрицательном тропонине Т эти показатели составили соответственно 9,4 и 7,5%). Видимо, повышенный уровень тропонина Т позволяет выделить больных с высоким риском осложнений, которым особенно нужны блокаторы гликопротеида IIb/IIIa.
Сахарный диабет
Метаанализ нескольких исследований показал, что блокаторы гликопротеида IIb/IIIa уменьшают 30-дневную смертность при остром коронарном синдроме на фоне сахарного диабета (4,6% против 6,2%, р = 0,007). При коронарной ангиопластике по поводу острого коронарного синдрома у больных сахарным диабетом блокаторы гликопротеида IIb/IIIa оказались еще эффективнее (смертность снижалась с 4,0 до 1,2%, р = 0,002). По результатам того же метаанализа, в отсутствие сахарного диабета блокаторы гликопротеида IIb/IIIa на смертность не влияли (3,0 и 3,0%). Таким образом, блокаторы гликопротеида IIb/IIIa наиболее эффективны при остром коронарном синдроме на фоне сахарного диабета, особенно в сочетании с коронарной ангиопластикой.
Заключение
Метаанализ шести исследований с общим участием 31 402 больных с острым коронарным синдромом показал, что блокаторы гликопротеида IIb/IIIa уменьшают число смертей и инфарктов миокарда в течение 30 дней на 9% (10,8% против 11,8%, р = 0,015). В значительной мере эти результаты получены за счет больных, которым проводилась коронарная ангиопластика или коронарное шунтирование в течение 30 дней после госпитализации (относительный риск 0,89, 95% доверительный интервал 0,71—1,03).
Однако эти средства повышают риск тяжелых внечерепных кровотечений (с 1,4 до 2,4%, р< 0,0001).
Блокаторы гликопротеида IIb/IIIa для приема внутрь
Блокаторы гликопротеида IIb/IIIa для приема внутрь оказались неэффективны. Более того, они могут даже увеличивать смертность. Причина такой разницы в действии блокаторов гликопротеида IIb/IIIa для в/в введения и для приема внутрь непонятна.
Нитраты
Эффективность нитратов не доказана в рандомизированных исследованиях, однако они составляют основу лечения больных с нестабильной стенокардией.
Нитроглицерин под язык в таблетках или аэрозоле (0,4 мг/доза) дают сразу же и затем еще дважды с интервалом 5 мин до исчезновения боли в груди. Если боль остается, начинают в/в введение нитроглицерина (10—20 мкг/мин). Дозу быстро повышают (на 5—10 мкг/мин каждые 5—10 мин) до исчезновения боли. Однако следует соблюдать осторожность, чтобы не вызвать тяжелую артериальную гипотонию. Можно использовать нитраты для местного применения (нитроглицериновые пластыри, 0,2—0,6 мг/ч или мазь, 2,5—5 см каждые 6 ч) и для приема внутрь (изосорбида динитрат, 10—40 мг внутрь 3 раза в сутки или изосорбида мононитрат, 30—120 мг внутрь 1 раз в сутки).
Привыкание к нитратам может появиться уже в течение 24 ч от начала лечения, вероятность этого зависит от доз и интервалов между ними. При привыкании к нитратам для достижения эффекта приходится повышать дозы. После стабилизации состояния с в/в введения нитроглицерина переходят на препараты для приема внутрь или для местного применения с соблюдением интервалов между дозами для предупреждения привыкания.
Противопоказания — аллергия к нитратам, артериальная гипотония. Есть данные, что нитроглицерин, принятый в течение 24 ч после силденафила (Виагры), может вызвать артериальную гипотонию, инфаркт миокарда и даже смерть.
Бета-адреноблокаторы
Бета-адреноблокаторы устраняют ишемию миокарда, уменьшая его потребность в кислороде за счет снижения АД, ЧСС и сократимости миокарда. Метаанализ 4 700 больных с нестабильной стенокардией показал, что бета-адреноблокаторы уменьшают частоту инфарктов миокарда, однако четкого влияния их на смертность получено не было.
При продолжающейся боли бета-адреноблокаторы вводят для устранения ишемии. Цель лечения — снизить ЧСС до 50—60 мин-1 и устранить боль. Обычно используют бета-1-адреноблокаторы (например, метопролол или атенолол), поскольку они вызывают меньше побочных эффектов.
Противопоказания к бета-адреноблокаторам включают выраженную АВ-блокаду, тяжелый бронхоспазм, кардиогенный шок, артериальную гипотонию, брадикардию и декомпенсированную сердечную недостаточность.
При сохранении боли в груди или стойкой артериальной гипертензии бета-адреноблокаторы вводят в/в. Метопролол можно вводить по 5 мг каждые 5—10 мин до достижения нужных ЧСС и АД. После этого можно переходить на метопролол для приема внутрь в начальной дозе 25—50 мг каждые 6— 12 ч, затем дозу при необходимости увеличивают.
Антагонисты кальция
Фармакодинамика антагонистов кальция разнообразна, они вызывают вазодилатацию, замедляют АВ-проводимость, оказывают отрицательное инотропное и хронотропное действие. Метаанализ исследований, в которых изучались антагонисты кальция при нестабильной стенокардии, не выявил их влияния на смертность и число инфарктов миокарда Однако нифедипин короткого действия по сравнению с метопрололом увеличивает риск инфаркта миокарда и повторной стенокардии. Дилтиазем может уменьшать число осложнений при нестабильной стенокардии без сердечной недостаточности. При систолической дисфункции левого желудочка или признаках застоя в легких при физикальном исследовании дилтиазем ухудшает прогноз
Антагонисты кальция при нестабильной стенокардии дают только при противопоказаниях к бета-адреноблокаторам или при продолжающейся ишемии, не поддающейся лечению бета-адреноблокаторами и нитратами. Антагонисты кальция — лучшие средства при вазоспастической стенокардии и при спазме коронарных артерий, вызванном кокаином.
Антагонисты кальция противопоказаны при систолической дисфункции левого желудочка, признаках сердечной недостаточности, артериальной гипотонии и АВ-блокаде.
Ингибиторы АПФ
При инфаркте миокарда с подъемом сегмента ST и при систолической дисфункции левого желудочка ингибиторы АПФ повышают выживаемость и препятствуют постинфарктной перестройке левого желудочка. Польза ингибиторов АПФ при нестабильной стенокардии и инфаркте миокарда без подъема сегмента ST менее очевидна. Тем не менее их обязательно дают при систолической дисфункции левого желудочка. Впрочем, учитывая данные о благоприятном действии ингибиторов АПФ при ИБС, их можно давать всем больным с острым коронарным синдромом.
Ингибиторы ГМГ-КоА-редуктазы (статины)
Ингибиторы ГМГ-КоА-редуктазы (статины) — обязательный компонент первичной и вторичной профилактики ИБС. Эти средства показаны всем больным с нестабильной стенокардией и повышенным холестерином ЛПНП (> 100 мг%, или > 2,59 ммоль/л) или общим холестерином (> 200 мг%, или 5,18 ммоль/л). Раннее назначение ингибиторов ГМГ-КоА-редуктазы может улучшать прогноз больных с острым коронарным синдромом без подъема сегмента ST.
В исследовании MIRACL с участием 3 086 больных с острым коронарным синдромом без подъема сегмента ST лечение аторвастатином, начатое в течение 24—96 ч после поступления, снижало риск смерти, инфаркта миокарда, остановки кровообращения и повторной ишемии в течение 16 нед (14,8% против 17,4%, относительный риск 0,84, 95% доверительный интервал 0,70—1,00, р = 0,048). Основной эффект был получен за счет повторной ишемии. Польза раннего назначения ингибиторов ГМГ-КоА-редуктазы может быть отчасти обусловлена их так называемым «плейотропным» действием, то есть не связанным со снижением уровня холестерина. В настоящее время проводятся дополнительные исследования ингибиторов ГМГ-КоА-редуктазы при остром коронарном синдроме.
Антиаритмические средства
При гемодинамически значимых желудочковых аритмиях используют амиодарон или лидокаин. В метаанализе, включавшем 26 416 больных с острым коронарным синдромом без подъема сегмента ST, общая частота фибрилляции желудочков и желудочковой тахикардии составила 2,1%. Желудочковые нарушения ритма указывали на неблагоприятный 30-дневный и 6-месячный прогноз. Однако профилактическое назначение таких антиаритмических средств, как флекаинид и энкаинид, при частой желудочковой экстрасистолии увеличивает смертность.
Тромболитики
Если при инфаркте миокарда с подъемом сегмента ST тромболизис уменьшает смертность и улучшает систолическую функцию левого желудочка, то при нестабильной стенокардии и инфаркте миокарда без подъема сегмента ST тромболизис ухудшает прогноз. По данным метаанализа, тромболизис при нестабильной стенокардии увеличивает число смертей и инфарктов миокарда по сравнению с плацебо (9,8% против 6,9%). Неэффективность тромболизиса может быть вызвана повышенной склонностью к тромбообразованию, возникающей из-за обнажения тромбина, связанного с фибрином, при растворении тромба. Склонность к тромбообразованию поддерживается за счет образования плазмина и активации тромбоцитов. При всем этом собственно на коронарный кровоток тромболитики почти не влияют, поскольку окклюзии коронарной артерии нет.
Коронарная ангиопластика
Коронарная ангиопластика при остром коронарном синдроме без подъема сегмента ST преследует две цели: устранение симптомов (в частности, стенокардии) и улучшение прогноза (предотвращение смерти, инфаркта миокарда и повторной ишемии). Исследования, проведенные в 1980-х гг., показали, что результаты коронарной ангиопластики при нестабильной стенокардии хуже, чем при стабильной. В исследовании TIMI IIIb при коронарной ангиопластике у больных с нестабильной стенокардией в 2,7% случаев возникал инфаркт миокарда, в 1,4% случаев требовалось экстренное коронарное шунтирование, а 0,5% случаев заканчивались смертью. Хотя ближайшие результаты были отличными в 96% случаев, в течение 1 года 28% больным требовалась повторная реваскуляризация.
Коронарные стенты снижают риск повторной окклюзии сосуда и повторного стеноза после коронарной ангиопластики. В настоящее время при коронарной ангиопластике широко используются стенты. Ретроспективный анализ не выявил значимых различий в частоте осложнений и повторных стенозов после стентирования у больных со стабильной и с нестабильной стенокардией Однако, по некоторым данным, стентирование при нестабильной стенокардии все же повышает риск ишемических осложнений.
Медикаментозная поддержка (например, блокаторы гликопротеида IIb/IIIа) уменьшает риск ишемических осложнений во время процедуры и улучшает долгосрочный прогноз после коронарной ангиопластики (см. выше).
Коронарное шунтирование
Направляя больного на коронарное шунтирование, учитывают множество факторов, в том числе: возраст, сопутствующие заболевания, тяжесть поражения коронарных артерий, проводилось ли ранее коронарное шунтирование и коронарная ангиопластика, техническую выполнимость коронарной ангиопластики и вероятность получить при этом хорошие результаты.
Большинство исследований, сравнивавших коронарное шунтирование с медикаментозным лечением, проводилось в 1970-е и 1980-е гг. Позже в исследовании BARI коронарное шунтирование сравнивали с коронарной ангиопластикой у больных с двух-и трехсосудистым поражением. В этом исследовании коронарное шунтирование повышало семилетнюю выживаемость при сопутствующем сахарном диабете (76,4% против 55,7% при коронарной ангиопластике, р= 0,0011). При этом 64% больных, участвовавших в исследовании, поступали в больницу с нестабильной стенокардией.
То обстоятельство, что больной поступил с острым коронарным синдромом без подъема сегмента ST, не должно влиять на выбор между коронарной ангиопластикой и коронарным шунтированием. Коронарное шунтирование может оказаться предпочтительным при сахарном диабете, систолической дисфункции левого желудочка, тяжелом поражении коронарных артерий (например, поражение ствола левой коронарной артерии, трехсосудистое поражение или двухсосудистое поражение с поражением дистальной части передней нисходящей артерии, а также снижение сократимости или появление ишемии при нагрузочных пробах). Однако эти рекомендации недолговечны, поскольку и коронарная ангиопластика, и коронарное шунтирование постоянно совершенствуются.
Внутриаортальная баллонная контрпульсация (ВАБК)
При нестабильной стенокардии, не поддающейся медикаментозному лечению, можно использовать внутриаортальную баллонную контрпульсацию. Она снижает потребность миокарда в кислороде и увеличивает перфузионное давление в коронарных артериях и за счет этого иногда мгновенно прекращает стенокардию и устраняет ишемические изменения ЭКГ. Однако внутриаортальная баллонная контрпульсация у таких больных должна использоваться только в качестве переходного этапа на пути к реваскуляризации.
Ранний инвазивный и консервативный подход
Несмотря на активную антиагрегантную, антикоагулянтную и антиангинальную терапию, риск повторной ишемии, инфаркта миокарда и смерти при остром коронарном синдроме без подъема сегмента ST остается высоким. По данным исследований ESSENCE и ТIМI IIВ, у 32% больных с инфарктом миокарда без подъема сегмента ST возникает повторная ишемия, требующая срочной реваскуляризации или приводящая к инфаркту миокарда. Ранняя коронарная ангиография может выявить тех больных, которым особенно нужна коронарная ангиопластика или коронарное шунтирование. Кроме того, она может способствовать снижению затрат и сокращению сроков госпитализации. Однако примерно у 15% больных с острым коронарным синдромом без подъема сегмента ST при коронарной ангиографии не обнаруживается значимых стенозов. Пользу ранней диагностики и лечения необходимо соотносить с риском неоправданных инвазивных исследований.
Данные клинических исследований
В исследовании TIMI IIIb участвовало более 1 400 больных с острым коронарным синдромом (инфарктом миокарда без патологических зубцов Q или нестабильной стенокардией); часть из них получала исключительно медикаментозное лечение, другим проводили раннюю коронарную ангиографию и полную реваскуляризацию в течение 1—2 сут после поступления. В группе медикаментозного лечения коронарная ангиография и реваскуляризация проводилась только при повторной ишемии или положительных результатах нагрузочных проб. Через 1 год смертность и частота инфарктов миокарда в обеих группах были примерно одинаковыми (10,8% в группе медикаментозного лечения и 12,2% в группе раннего инвазивного лечения). Однако в группе инвазивного лечения быломеньше госпитализаций и повторной стенокардии. У пожилых больных (> 65 лет) отмечалось значительное снижение смертности и числа инфарктов через 6 нед. при раннем инвазивном лечении (7,9% против 14,8%). В группе медикаментозного лечения к концу наблюдения 64% больных была выполнена коронарная ангиография и при необходимости — реваскуляризация, что могло сделать менее явными преимущества раннего инвазивного лечения.
В исследовании VANQWISH, проведенном в клиниках для ветеранов, медикаментозное и раннее инвазивное лечение сравнивали у 920 больных с инфарктом миокарда без патологических зубцов Q. При инвазивном лечении отмечалось повышение ранней смертности, вызванное в основном высокой периоперационной летальностью при коронарном шунтировании (11,6%). В группе медикаментозного лечения 29% больных в конце наблюдения была сделана коронарная ангиография. При длительном наблю-
дении (в среднем 23 мес) риск смерти и инфаркта миокарда в двух группах достоверно не различался.
В исследовании FRISC II больные с острым коронарным синдромом без подъема сегмента ST были случайным образом разделены на 4 группы по двум параметрам: раннее инвазивное или медикаментозное лечение и далтепарин или плацебо. Раннее инвазивное лечение снижало риск смерти и инфаркта миокарда в течение 6 мес (9,4% против 12,1%, р = 0,031) и уменьшало симптомы стенокардии и число повторных госпитализаций независимо от лечения далтепарином.
В исследовании TACTICS—TIMI-18 больных с острым коронарным синдромом без подъема сегмента ST, получавшие аспирин, гепарин и тирофибан, были разделены на две группы: раннего инвазивного лечения и медикаментозного лечения. В группе раннего инвазивного лечения в первые 4—48 ч проводилась коронарная ангиография и при необходимости реваскуляризация. В группе медикаментозного лечения коронарная ангиография проводилась только при повторной ишемии или положительных результатах нагрузочных проб. Раннее инвазивное лечение снижало риск смерти, инфаркта миокарда и повторных госпитализаций по поводу острого коронарного синдрома в течение 6 мес (15,9% против 19,4%, р = 0,025), а также риск смерти и инфаркта миокарда в течение 6 мес (7,3% против 9,5%, р < 0,05).
В исследовании RITA-3 раннее инвазивное лечение острого коронарного синдрома без подъема сегмента ST у больных со средним риском осложнений снижало риск смерти, инфаркта миокарда и повторной стенокардии в течение 4 мес по сравнению с медикаментозным лечением (9,6% против 14,5%, р = 0,001). В основном это происходило за счет повторной стенокардии. Таким образом, раннее инвазивное лечение может быть показано даже больным со средним риском осложнений. Врачи, проводившие исследование RITA-3, представили метаанализ исследований, сравнивавших раннее инвазивное лечение с медикаментозным. По данным этого метаанализа, раннее инвазивное лечение сопровождается меньшим риском смерти и инфаркта миокарда в течение 1 года (относительный риск 0,88, 95% доверительный интервал 0,78—0,99).
Критика
Исследования TIMI IIIb и VANQWISH были подвергнуты серьезной критике из-за того, что в них проведение коронарной ангиопластики не соответствовало современным стандартам (не использовали стенты, не назначали блокаторы гликопротеида IIb/IIIа), а также из-за того, что многим больным из группы медикаментозного лечения в конце концов проводили реваскуляризацию. Во всех упомянутых выше исследованиях, за исключением TIMI IIIb и VANQWISH, результаты раннего инвазивного лечения оказались лучше.
По рекомендациям Американской коллегии кардиологов и Американской кардиологической ассоциации раннее инвазивное лечение показано при любых из нижеперечисленных факторов высокого риска:
- повышение уровня тропонинов
- новая депрессия сегмента ST
- повторяющаяся стенокардия с признаками сердечной недостаточности в покое или при минимальной физической нагрузке на фоне антиангинальной терапии
- резко положительные результаты нагрузочных проб
- систолическая дисфункция левого желудочка {фракция выброса менее 40%)
- нестабильная гемодинамика
- устойчивые пароксизмы желудочковой тахикардии
- коронарная ангиопластика в предшествующие 6 мес
- коронарное шунтирование в анамнезе.
Остальных больных можно лечить как инвазивно, так и медикаментозно.
Сочетание блокаторов гликопротеида IIb/IIIa с низкомолекулярными гепаринами изучается в настоящее время. В исследованиях ACUTE II и INTERACT сочетание этих средств, по-видимому, не повышало риск кровотечений, а по эффективности было примерно таким же, как при сочетании блокаторов гликопротеида IIb/IIIa с нефракционированным гепарином. Остается неясным, есть ли какие-либо преимущества у такого сочетания, Кроме того, остаются вопросы относительно применения низкомолекулярного гепарина при коронарной ангиопластике и перед коронарным шунтированием. Некоторые из этих вопросов поставлены в еще не завершившихся клинических исследованиях.
Амбулаторное наблюдение
Лечение при нестабильной стенокардии обычно подбирается в больнице, тем не менее после выписки больному необходимо наблюдение врача. Рекомендаций относительно нагрузочных проб после успешной коронарной ангиопластики или коронарного шунтирования не разработано. При повторении стенокардии после выписки в зависимости от клинической ситуации проводят нагрузочные пробы или же сразу коронарную ангиографию. Необходим отказ от вредных привычек, воздействие на факторы риска атеросклероза, проведение вторичной профилактики ИБС. В отсутствие тяжелой стенокардии и сердечной недостаточности показаны регулярные физические нагрузки. Важен отказ от курения и соблюдение диеты. Надо продолжать прием аспирина, клопидогреля, бета-адреноблокаторов, ингибиторов ГМГ-КоА-редуктазы и других гиполипидемических средств и ингибиторов АПФ. Проводят активное выявление и лечение артериальной гипертензии, гиперлипопротеидемии и сахарного диабета. С симптоматической целью используют нитраты, бета-адреноблокаторы, иногда антагонисты кальция. Больным обязательно объясняют допустимый и необходимый уровень физической нагрузки.
Лечение стенокардии в Беларуси - европейское качество за разумную цену
Литература
1. Б.Гриффин, Э.Тополь «Кардиология» Москва, 2008
2. В.Н. Коваленко «Руководство по кардиологии» Киев, 2008


