Хирургия ИБС началась в 1935, когда Beck пришил участок большой грудной мышцы на ножке к сердцу в попытке обеспечить поставку дополнительной крови. В 1941 Beck сообщил о механическом сужении коронарного синуса и создании спаечного процесса в перикарде с помощью различных средств для улучшения кровотока в миокарде. В 1951, Vineberg описал внедрение внутренней грудной артерии непосредственно в миокард.
В конце 1950-ых Bailey описал прямую коронарную эндартерэктомию, а в 1961, Senning - ангиопластику участка стеноза коронарной артерии. В 1964, Е.Н. Колесов в Ленинграде выполнил первый анастомоз между левой внутренней грудной артерией и левой передней межжелудочковой артерией. В 1968, Favolaro впервые сообщил об успешном использовании вен для шунтирования пораженных коронарных артерий. С конца 1960-ых и в начале 1970-ых популярность аортокоронарного шунтирования (АКШ) быстро росла и оно стало в настоящее время одной из обычно выполняемых основных операций.
Показания к операции рассматриваются как сочетание определенных анатомических особенностей поражения коронарных артерий и физиологических осложнений - миокардиальной ишемии, инфаркта миокарда и дисфункции левого желудочка. Вообще, осуществляется шунтирование только коронарных артерий с существенным (больше чем 70%) стенозом, потому что кровоток по шунту может быть серьезно ограничен конкурентоспособным кровотоком по нативной коронарной артерии.
Пациент должен подвергнуться полной диагностике, сосредоточенной на идентификации существующей сердечно-сосудистой патологии, сопутствующих заболеваний (пожилой возраст, хроническая легочная патология, диабет, почечная и печеночная недостаточность, желудочно-кишечное кровотечение, нарушения свертывающей системы, ВИЧ инфекция, предшествующая хирургия, радио- или химиотерапия) и выявлены проблемы, которые могут воздействовать на технические аспекты операции. Определяется объем шунтирования и выбор материала для шунтов. Пациент должен быть фармакологически и гемодинамически оптимизирован с помощью стандартной или дополнительной дооперационной подготовки.
Анестезия и искусственное кровообращение проводятся стандартно.
Содержание:
Выбор кондуита
Стандартный доступ для аортокоронарного шунтирования (АКШ) - срединная стернотомия. Альтернативные разрезы включают частичную стернотомию, правую и левую торакотомию и используются для шунтирования строго определенных коронарных бассейнов и часто требуют бедренного артериального и/или венозного подключения искусственного кровообращения (ИК).
Выбор кондуита для шунтирования коронарной артерии осуществляется исходя из возраста пациента, соматического статуса, целевых коронарных артерий, пригодности кондуита и предпочтения хирурга.
Внутренняя грудная артерия
Внутренняя грудная артерия обладает молекулярными и клеточными особенностями, которые определяют ее уникальное сопротивление атеросклерозу и чрезвычайно высокую долговечность в качестве шунта. Структурно она не имеет vasa vasorum. Плотная без фенестраций интима предотвращает миграцию клеток, инициирующую гиперплазию. Внутренняя грудная артерия обладает тонкой медией с небольшим количеством гладкомышечных клеток, что обеспечивает сниженную вазореактивность. В отличие v. saphenous гладкие мышцы внутренней грудной артерии мало способны к пролиферативной реакции в ответ на воздействие факторов роста. Пульсирующее механическое воздействие - мощный митогенный фактор для v. saphenous также не влияет на стенку артерии. Эндотелий внутренней грудной артерии производит значительно больше простациклина (вазодилататора и ингибитора тромбоцитов) и NO, противодействующего мощным вазоконстриктивным эффектам эндогенного endothelin-1. Внутренняя грудная артерия хорошо дилатируется милриноном и не спазмируется норадреналином. Нитроглицерин вызывает вазодилатацию внутренней грудной артерии, но не v.saphenous. Электронная микроскопия анастомотических участков внутренней грудной артерии и вены выявила большие тромбогенные дефекты с разорванными волокнами коллагена интимы вены и отсутствие повреждений последней в артерии. Липидный и глюкозоаминогликанный состав внутренней грудной артерии по сравнению с v. saphenous предполагает большую способность к атерогенезу в стенке вены. Наконец, внутренняя грудная артерия может адаптироваться к меняющемуся кровотоку и как часто наблюдается, увеличивается в диаметре в отдаленном послеоперационном периоде.
Техника забора внутренней грудной артерии
Выделение внутренней грудной артерии начинается немедленно после стернотомии. Специальный ретрактор обеспечивает ассиметричное раскрытие раны для доступа к внутренней поверхности грудной клетки. Необходимо помнить, что чрезмерное растяжение при этом может вызвать травму плечевого сплетения.
Уменьшается объем вентиляции. Забор может быть начат в любом месте по ходу внутренней грудной артерии. Диатермокоагулятором проводится тщательное выделение артерии с отходящими от нее боковыми ветвями. В зависимости от размера, боковые артериальные и венозные ветви к стенке грудной клетки коагулируются или клипируются металлическими скрепками. Забор может выполняться по двум методикам: с окружающими тканями и в виде полной скелетизации артерии. Преимуществом первого способа является низкая вероятность травматизации артерии. Преимущество второго метода – большая возможная длина внутренней грудной артерии и сохранение анастомозов межреберных артерий, питающих грудину, поскольку боковые ветви клипируются непосредственно у стенки внутренней грудной артерии. При недостаточной длине внутренней грудной артерии при заборе ее в блоке с тканями, длина кондуита может быть увеличена несколькими поперечными разрезами фасции через каждые 1,5 см. Отсутствие пульсации артерии при выделении не обязательно коррелирует с низким потоком крови по ней. 
Выделение и подготовка для дистального анастомоза внутренней грудной артерии
После выделения всей внутренней грудной артерии с обязательным клипированием наиболее крупной боковой ветви в первом межреберном промежутке, проводится системная гепаринизация, и артерия отсекается на 1 см выше бифуркации. Оценивается кровоток по артерии, при сомнении в его эффективности используется обработка внутренней грудной артерии папаверином. При этом желательного избегать проверки проходимости артерии бужом или нагнетанием раствора папаверина в просвет артерии, чтобы не повредить интиму.
Подготовка внутренней грудной артерии для дистального анастомоза может быть выполнена в любое удобное время. Варианты включают подготовку
2) после определения места наложения дистального анастомоза;
3) во время кардиоплегии или
4) после артериотомии коронарных артерий.
Преимущество более ранней подготовки – небольшое сокращение времени пережатия аорты. Преимущество более поздней подготовки – возможность максимального сокращения длины внутренней грудной артерии для использования участка с большим диаметром. Дистальный конец артерии осторожно отделяется от окружающих тканей и рассекается продольно.
Улучшение отдаленных результатов после использования двух маммарных артерий привело к увеличению билатерального маммарокоронарного шунтирования. Получила развитие концепция создания искусственной артериальной аркады из двух внутренних грудных артерий для реваскуляризации миокарда, подобно существующим естественным артериальным анастомозам типа Велизиева круга или ладонной артериальной дуги. Двустороннее использование внутренней грудной артерии не рекомендуется у пациентов с диабетом и хроническими заболеваниями легких, так как чревато развитием стернальной инфекции.
Левая внутренняя грудная артерия используется для шунтирования преимущественно передней межжелудочковой ветви (ПМЖВ) или секвенциально диагональной ветви и ПМЖВ. Возможно также ее применение для шунтирования и системы огибающей артерии. Правая внутренняя грудная артерия может быть использована для шунтирования правой коронарной артерии или проксимальных отделов огибающей артерии. Для этого необходимо проведение ее позади аорты через поперечный синус, что может стать причиной нарушения ее функции. Размещение правой внутренней грудной артерии на передней поверхности сердца при шунтировании ПМЖВ может привести к ее травме при повторном вмешательстве. В этой связи в последнее время при билатеральном шунтировании получило широкое распространение использование правой внутренней грудной артерии в виде свободного графта, анастомозируя ее с левой внутренней грудной артерии.
Лучевая артерия
Использование лучевой артерии как кондуита для АКШ было предложено А. Carpentier в 1973. Первые результаты оказались неудовлетворительными, и интерес в использовании этого кондуита исчез. Лучевая артерия обладает выраженной медией с большим количеством гладкомышечных клеток, вследствие чего способна к спазму. Всплеск популярности в использовании радиальной артерии развился после появления концепции полной артериальной реваскуляризации миокарда, как метода, позволяющего значительно улучшить отдаленные результаты хирургического лечения ИБС. Увеличению длительности хорошей функции лучевой артерии способствовало изменение техники забора артерии без ее скелетизации, в комплексе с прилегающими тканями, использование антагонистов кальция, нитратов и статинов, и выбор места анастомоза с коронарной артерией, обеспечивающем хороший отток. Оценка пригодности лучевой артерии как кондуита проводится с помощью теста Алена или дуплексной ультрасонографии.
Техника забора лучевой артерии
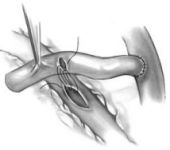
Как правило, забор артерии проводится с недоминирующей (левой) руки. Продольный, немного изогнутый разрез кожи выполняется в проекции радиальной артерии с особым вниманием к уходу от бокового кожного нерва предплечья, ранение которого приводит к нарушению чувствительности предплечья. Артерия выделяется в блоке с окружающими тканями, избегая при этом повреждения поверхностного лучевого нерва, который находится вблизи боковой стенки в средней трети артерии. Парестезия и нарушения чувствительности наблюдаются у 25-50% пациентов, у большинства из которых они существуют непродолжительное время и длительно сохраняются только у 5-10% больных. После системной гепаринизации артерия отсекается и хранится в растворе гепарина с антагонистами кальция или папаверином. В последнее время стал возможным эндоскопический метод забора артерии. 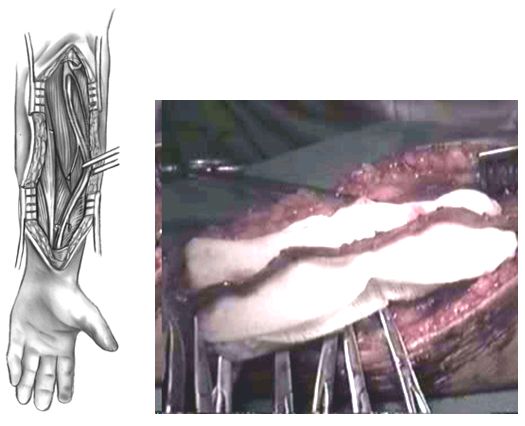
Выделение лучевой артерии
Желудочно-сальниковая артерия
Желудочно-сальниковая артерия (arteria gastroepiploica) была впервые использована в качестве кондуита в коронарной хирургии в 1984 Pym, как вынужденный шунт при отсутствии других подходящих кондуитов. В настоящее время артерия используется как вторичный кондуит при выполнении полной артериальной реваскуляризации и частота ее применения снизилась вследствие определенных затрат времени для забора и вскрытия дополнительной (брюшной) полости с потенциальными осложнениями. Однако, физиологические исследования желудочно-сальниковой артерии показывают эквивалентные внутренней грудной артерии биологические особенности.
Предшествующая желудочная хирургия, лучевая терапия служат противопоказанием для использования этого сосуда.
Техника забора желудочно-сальниковой артерии
Выделение артерии проводится после продления стернотомного разреза вниз и выполнения верхней срединной лапаротомии. Артерия визуализируется и выделяется из жировой ткани, при этом последовательно клипируются боковые ветви. Дистально выделение продолжается до 2\3 большой кривизны желудка, а проксимально - по направлению к двенадцатиперстной кишке до пилорического отдела желудка.
Выделение правой желудочно-сальниковой артерии
После отсечения дистальной части артерии, она проводится через диафрагму в полость перикарда в зависимости от целевой коронарной артерии. Вход в перикард должен быть близко к шунтируемой коронарной артерии, и давать возможность свободного размещения нескольких сантиметров а. gastroepiploica, чтобы обеспечить анастомоз без излишнего натяжения. В некоторых случаях артерия может быть использована в виде свободного кондуита.
Большая подкожная вена бедра
Большая подкожная вена до настоящего времени продолжает оставаться наряду с внутренней грудной артерией основным кондуитом для коронарной хирургии, так как имеет много преимуществ, включая пригодность, доступность, простоту забора и многосторонность в использовании. Она не пригодна в качестве шунта при варикозе и склерозе. Венозный шунт уступает артериальным, так как в процессе артериализации способен к склерозу и раннему развитию атеросклероза.
Техника забора большой подкожной вены
Методы забора v.saphenous различаются в зависимости от требуемой длины. Длина каждого из шунтов составляет от 10 до 20 см. Забор может быть начат в верхней части бедра, выше колена, или на лодыжке. Идентификация большой подкожной вены наиболее проста на 1 см кнаружи от внутренней лодыжки. Пациенты с периферическими сосудистыми поражениями должны подвергнуться забору вены, начатому на бедре. В нижней 1\3 голени непосредственно к большой подкожной вене прилежит n. saphenous, который должен быть сохранен, так как его повреждение может привести к ограниченной потере чувствительности или гиперестезии. Используется открытая техника, когда кожный разрез проводится над всей поверхностью вены, выделение вены из отдельных кожных разрезов или полностью эндоскопическая техника. Во всех случаях боковые ветви тщательно лигируются. После выделения большая подкожная вена канюлируется, проверяется на герметичность гидравлическим бужированием и помещается в раствор с папаверином.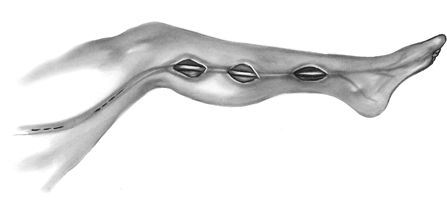
Выделение большой подкожной вены
Образование вторичной неоинтимы в большой подкожной вене происходит за счет дедифференциации сосудистых гладкомышечных клеток, приводящей к их миграции, пролиферации с последующим развитием значительного утолщения стенки графта. Различные способы обработки вен, к сожалению, не принесли результатов, позволяющих увеличить продолжительность эффективного функционирования последних в артериальных позициях. Ингибиторный эффект фотооксидации на пролиферативную активность сосудистых гладкомышечных клеток и фибробластов адвентиции препарированной вены in vitro был изучен Chanada и соавторами в 1998 г. Использование экзогенных фотосенсибилизаторов (0,01% метиленового синего) для катализации данного процесса и экспериментальная оценка на венах кролика in vivo впервые показана Ke-Xiang Liu и соавт. в 1999 году.
Мы исследовали индуцированную мероцианином-540 (Мц-540) фотооксидацию венозных графтов собак с последующей их имплантацией в артериальное русло животных на 3 месяца. Мц 540 – флуоресцентный зонд, обладает амфифильными свойствами и имеет отрицательно заряженную группу.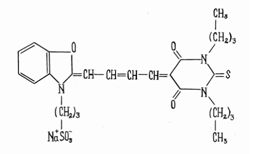
Химическая формула мероцианина
Мероцианин-540 не проникает внутрь клетки и встраивается преимущественно в гидрофобные области клеточной мембраны, в присутствии сыворотки крови избирательно связывается с незрелыми дедифференцированными и трансформированными клетками. При сенсибилизированном Мц-540 фотодинамическом воздействии удар приходится на плазматическую мембрану, что подтверждается фотоинактивацией мембраносвязанных ферментов и фотоокислением мембранных липидов. При освещении клеток в присутствии красителя резко возрастало перекисное окисление липидов, уменьшалось количество SH-групп и наблюдалось перекрестное сшивание белков. Нами был определен оптимальный режим воздействия Мц 540 концентрации сенсибилизатора (5х10-6М) и мощность фотосенсибилизации (25 кДж/м2) на стенку вены, при котором бы произошло фотоиндуцированное повреждение активно пролиферирующих клеток без изменений эндотелиального слоя в эксперименте. 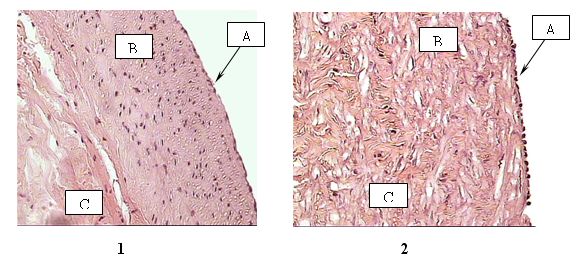
Гистологическое исследование стенки большой подкожной вены. Необработанная вена (1); Вена после процесса фотооксидации с мероцианином (2). А – интима; В – медиа; С – адвентиция.
В результате исследования выявлена способность клеток наружной и средней оболочек вен к связыванию фотосенсибилизатора, что позволило использовать данный хромофор для фотоиндуцированного изменения структуры стенки вены путем повреждения активно пролиферирующих гладкомышечных клеток медии и фибробластов наружной и средней оболочек.
Полученные нами данные свидетельствуют о перспективности метода, основанного на ремоделировании структуры стенки венозного шунта под действием света в присутствие Мц-540. Возможно, данный феномен приведет к увеличению сроков функционирования венозных графтов в артериальных позициях.
Альтернативные неаутогенные сосудистые кондуиты также могут использоваться для шунтирования коронарных артерий. Они включают криоконсервированную человеческую большую подкожную вену, аутологичные эндотелизированные вены, обработанную глутаральдегидом бычью a. sacralis и различные синтетические сосудистые протезы (политетрафторэтилен). Указанные кондуиты не обладают долговечностью, часто тромбируются и не считаются приемлемыми коронарными шунтами. Продолжается поиск других кондуитов, таких как эндотелизированные синтетические протезы.
Техника операции
У пациентов, подвергающихся реваскуляризации миокарда важна оценка восходящего отдела аорты в месте ее канюляции, наложения поперечного и бокового зажимов, так как локальный кальциноз может стать причиной расслоения аорты и нарушения функции шунтов. В этих случаях должны использоваться альтернативные точки канюляции (бедренные или подключичные артерии), а наложение проксимальных анастомозов может проводиться в момент остановки сердца или должны использоваться внутренние грудные артерии (sutureless, clampless техника).
Для канюляции аорты накладываются два кисетных шва 3\0, адвентиция аорты надсекается. В момент канюляции артериальное давление должно строго контролироваться для профилактики диссекции аорты. После введения канюли последняя обжимается турникетами кисетных швов и соединяется с артериальной магистралью АИК. Канюляция правого предсердия проводится двухпросветной канюлей через кисетный шов 3\0. Канюля для ретроградной и антеградной кардиоплегии вводятся через кисетный шов 4\0 на правом предсердии и в восходящую аорту после освобождения ее стеки от жира. До начала ИК полезно попытаться определить длину шунтов.
Пациентам с умеренной аортальной недостаточностью, не требующей коррекции, проводится дренирование левого желудочка через правую верхнюю легочную вену. Это обычно выполняется немедленно после начала ИК во избежание воздушной эмболии. ИК проводится без гипотермии. После пережатия аорты кровяная кардиоплегия проводится через корень аорты (антеградно), затем все последующие введения – в коронарный синус (ретроградно). Для больных ИБС этот путь доставки кардиоплегического раствора важен, так как коронарные стенозы препятствуют равномерному поступлению раствора в отдельные участки миокарда.
Артериотомия
Место артериотомии определяется согласно данным ангиографии и визуальной эпикардиальной экспертизы. Участок артериотомии должен быть выбран достаточно близко к расположению стенозирующей бляшки в зоне отсутствия выраженного атеросклероза. Областей бифуркации если возможно следует избегать. Артерии с внутримиокардиальным местоположением вначале требуют рассечения вышележащей ткани. Локализация внутримиокардиальных судов может достигаться по эпикардиальным бороздам, сопровождающим венозным сосудам или слабой белесоватой полосе в пределах красновато-коричневого миокарда. Для идентификации ПМЖВ иногда приходится пользоваться бужом, введенным в просвет артерии в области верхушки.
Вскрытие артерии производится скальпелем № 11, избегая повреждения задней стенки, затем коронарными ножницами стенка рассекается в проксимальном и дистальном направлении на дину 5 мм. 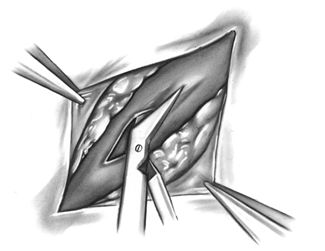
Коронарная артериотомия
Техника наложения дистального анастомоза
Предварительно подготовленный (скошенный или зубчатый) кондуит подводится к месту наложения анастомоза. Длина разреза кондуита должна несколько превышать длину разреза коронарной артерии, что препятствует кисетному сужению анастомоза при затягивании нити. Скошенный край кондуита обеспечивает более точное прилегание анастомоза, но способен вызвать сужение анастомоза в области пятки. Зубчатый край кондуита несколько сложнее в адаптации краев анастомоза, но лишен основного недостатка скошенного края. Используются различные методы наложения анастомоза, которые отличаются по различным аспектам: непрерывный шов против прерывистого, начинающийся с «пятки» или «носка», на основе парашютной техники или изначально фиксированный.
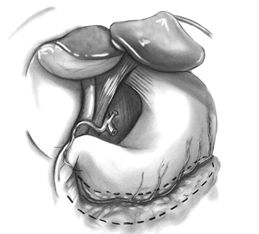
Авторы предпочитают непрерывный шов нитью 7\0 с применением парашютной техники, начинающийся с пятки кондуита. Анастомоз начинается вколом со стороны адвентиции кондуита отступя 2 мм от пятки, последующий вкол проводится со стороны интимы коронарной артерии на 2 мм отступя от проксимальной части разреза. Затем обвивной шов продолжается в сторону пятки кондуита до наложения 4-6 петель, после чего пятка кондуита парашютом опускается на разрез коронарной артерии. В дальнейшем обвивной непрерывный шов продолжается в сторону носка кондуита к дистальной части разреза коронарной артерии и завершается на противоположной стороне артерии. Необходимо обращать внимание на тщательное сопоставление интимы кондуита и коронарной артерии. Во время наложения анастомоза должно соблюдаться постоянное натяжение нити, а во время завязывания необходимо помнить о возможном стенозе анастомоза за счет кисетного эффекта.
Проводится проба на герметичность и проходимость анастомоза нагнетанием физиологического раствора в кондуит или освобождением окклюзирующего зажима со внутренней грудной артерией.
Меньшинство хирургов предпочитает использование прерывистого шва, чтобы избежать эффекта кисета. Скрепки Nitinol были недавно введенные в практику, чтобы облегчить наложение прерывистого шва, избегая потребности в том, чтобы связать каждый из многочисленных швов.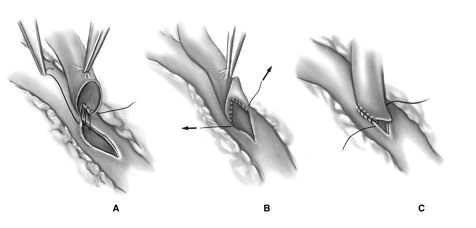
Формирование дистального анастомоза
Секвенциальный анастомоз
Секвенциальное (jumping) шунтирование позволяет увеличить количество дистальных анастомозов, экономя количество и длину кондуитов. Кроме того, основное преимущество такого вида шунта - эффективное увеличение оттока и объемной скорости кровотока по шунту, что снижает частоту нарушения функции кондуита. Секвенциальное шунтирование выполняется с использованием как артериальных, так и венозных кондуитов. Внутренняя грудная артерия, как правило, применяется для секвенциального шунтирования диагональной и передней межжелудочковой артерий.
Потенциальные дополнительные преимущества с последовательным пришиванием внутренней грудной артерии включают артериальную замену кровеносных сосудов второй цели, и существенного коронарного запаса потока во внутренней грудной артерии. Использование внутренней грудной артерии для многократных последовательных анастомозов системы огибающей ветви левой коронарной артерии также было описано. А.gastroepiploica применялась для последовательного шунтирования артерий на задней поверхности сердца. Одним из неудобств секвенциального шунтирования является возможный повышенный риск выключения из кровообращения большего сосудистого бассейна при нарушении функции кондуита, так потенциально большая область миокарда может быть подвергнута опасности.
Планируя выполнение последовательных анастомозов, самый отдаленный анастомоз должен быть наложен с наибольшей по диаметру артерией и самым большим потенциалом оттока. Если создана обратная ситуация, самый дистальный анастомоз имеет высокий риск нарушения функции, так как основной объемный поток будет шунтироваться в ближайшую коронарную артерию. Последовательные анастомозы выполняются с использование техники «бок в бок» с продольным рассечением как коронарной артерии, так и кондуита, при этом разрез кондуита должен быть на 1\3 больше разреза в коронарной артерии. Эти два разреза соединяются между собой в продольном, поперечном или косом направлениях в зависимости от конкретной анатомии коронарных сосудов. Наиболее часто используется ромбовидный (diamond) анастомоз. Формирование анастомоза начинается с дистального участка разреза кондуита вколом иглы 7\0 со стороны адвентиции. Место первого вкола со стороны интимы коронарной артерии выбирается таким образом, чтобы предотвратить повышенный изгиб или перекручивание кондуита. Последовательно накладывается 4-6 петель непрерывного обвивного шва, после чего кондуит парашютом опускается к разрезу коронарной артерии. Последующее выполнение анастомоза идентично описанному ранее при выполнении дистального коронарного анастомоза.
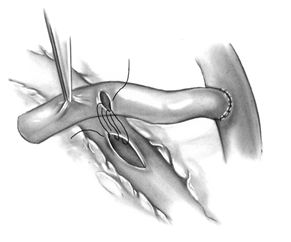
Формирование секвенциального анастомоза
Технические устройства для наложения дистальных анастомозов, основанные на использовании технологии стентирования до настоящего времени не нашли широкого применения, так как в результате их использования увеличилась частота дисфункции шунтов.
Коронарная эндартерэктомия
Коронарная эндартерэктомия - относительно нечасто используемая процедура и в настоящее время применяется только из артерий с распространенным атеросклерозом, которые обеспечивают кровоснабжение большой области миокарда, например ПМЖВ или ПКА. Чем больший диаметр коронарной артерии, тем больше шансов на успех процедуры. Первичным недостатком этого способа восстановления кровотока являются технические трудности и увеличение возможности тромбоза коронарной артерии в области эндартерэктомии или повторной окклюзии сосуда откидной створки интимы.
В настоящее время используются закрытая и открытая техники эндартерэктомии. Закрытая техника обычно применяется для правой коронарной артерии и состоит в продольной артериотомии, несколько большей по длине, чем стандартный разрез для шунтирования. Бляшка приподнимается пинцетом и острожными движениями отслаивается инструментом, типа лопаточки, от адвентиции артерии в проксимальном и дистальном направлении, насколько это возможно и извлекается из просвета артерии. В артериотомный разрез вшивается шунт.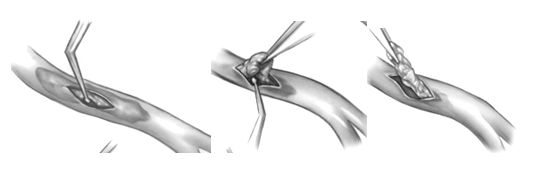
Закрытая эндартерэктомия
Открытая эндартерэктомия, как правило, проводится из ПМЖВ, так как позволяет освободить боковые ветви, питающие межжелудочковую перегородку. Для этого продольный разрез артерии проводится на максимальную длину, обеспечивающую наиболее полное извлечение атероматозно измененной интимы, после чего в образовавшийся дефект вшивается заплата из ауотовены. В последующем в заплату «конец в бок» вшивается внутренняя грудная артерия. 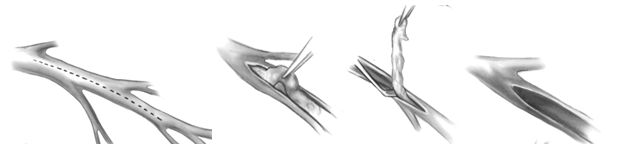
Открытая эндартерэктомия
Техника наложения проксимального анастомоза
Меньшинство хирургов предпочитает выполнять проксимальный анастомоз до выполнения дистальных анастомозов. Существует несколько преимуществ этой техники:
2) после завершения дистальных анастомозов и снятия поперечного зажима с аорты все области миокарда немедленно реваскуляризируются;
3) третье преимущество, которое является в то же самое время неудобством, состоит в том, что кондуиты должны быть измерены предварительно на полном, бьющемся сердце до начала ИК и приведены к соответствующей длине.
Существует много недостатков этой техники: боковое отжатие аорты при повышенном артериальном давлении увеличивает риск травмы стенки аорты и потенциально может вызвать ее расслоение; определенная заранее длина шунта может оказаться недостаточной если при ревизии коронарных артерий появится потребность в наложении анастомоза дистальнее первоначально выбранного места; наконец, отсутствует возможность проверки герметичности и проходимости анастомоза ручной подачей раствора.
Наложение проксимальных анастомозов может осуществляться на остановленном сердце при полностью пережатой аорте. Эта техника обычно используется, когда АКШ выполняется в сочетании с хирургией клапанного аппарата, но иногда при выраженном кальцинозе восходящего отдела аорты она используется и при чистой реваскуляризации миокарда. Преимущества по сравнению с другими методами, включают возможность выполнения проксимальных анастомозов на пустой аорте, что предотвращает дополнительные манипуляции на восходящей аорте и риск неврологических осложнений. Недостатком является более длительное время остановки сердца и потребность в деаэрации.
Выполнение проксимальных анастомозов проводится также с помощью бокового отжатия аорты. Эта техника - самый распространенный способ создания анастомозов кондуита с аортой, так как позволяет выполнение дистальных анастомозов на остановленном сердце, а проксимальных анастомозов - после восстановления сердечной деятельности на частично отжатой аорте, не увеличивая время ишемии миокарда. При этом риск расслоения аорты невысок, так как боковой зажим используется непродолжительное время и при полном ИК. После определения участка для наложения проксимальных анастомозов в этом месте удаляется периаортальная жировая ткань. Лезвием скальпеля №11 и панчем 4.8 для венозных шунтов и 4.0 для артериальных графтов формируются отверстия в передней стенке аорты. Проксимальный участок шунта отсекается до необходимой длины и скашивается или рассекается продольно на 2-3 мм.
Перед началом выполнения анастомоза пятка разреза кондуита позиционируется по отношению к аорте таким образом, чтобы после наложения анастомоза шунт к правой или левой коронарным артериям располагался свободно в обход правого предсердия или легочной артерии. Проленовой нитью 6\0 вколом со стороны адвентиции шунта отступя на 2-3 мм от пятки с последующим вколом со стороны интимы аорты накладывается первый виток шва. Затем обвивной шов продолжается в сторону пятки кондуита до наложения 4-6 петель, после чего пятка кондуита парашютом опускается на разрез аорты. В дальнейшем обвивной непрерывный шов продолжается в сторону носка кондуита и завершается на противоположной стороне аорты. Вторая игла может использоваться с другой стороны, для завершения другой половины анастомоза. Участок анастомоза должен быть отмечен хирургической скрепкой, чтобы облегчить, в случае необходимости будущую коронарографию. После окончания всех проксимальных анастомозов снимаются сосудистые зажимы с артериальных кондуитов для их ретроградного заполнения кровью, и убирается боковой зажим с аорты. Деаэрация проводится только из венозных шунтов путем пункции их кончиком иглы 7\0.
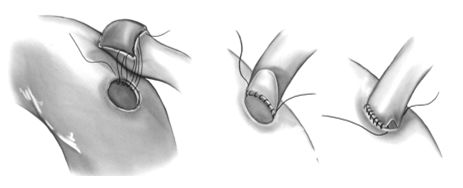
Формирование проксимального анастомоза
Композитные кондуиты
В настоящее время для решения проблем полной артериальной реваскуляризации, при недостаточной длине кондуитов, а также для того, чтобы избежать манипуляций на кальцинированной восходящей аорте, используются различные конфигурации Y-и T-графтов. Для этого в кондуите-доноре, чаще всего это левая внутренняя грудная артерия, выполняется продольный разрез (как правило, место разреза соответствует расположению клапана легочной артерии) и в него вшивается с использованием техники наложения дистального коронарного анастомоза a. radialis, предварительно анастомозированная с коронарной артерией из системы левой коронарной артерии. Недостатком является техническая сложность и недостаточная уверенность относительно единственного источника притока для двух или больше периферических коронарных целей.
Все артериальные Y-графты обычно планируются заранее и создаются до начала ИК. Композитное Y-шунтирование может также быть выполнено вместо секвенциального шунтирования, однако, по сравнению с последовательным шунтированием, эта техника требует дополнительного анастомоза, но может облегчить формирование дистальных анастомозов, которые из-за анатомических особенностей не могут быть идеально выполнены без дополнительного изгиба или перекрута шунта. Эта техника может также облегчить полную артериальную реваскуляризацию миокарда только внутренними грудными артериями. Другие виды композитных графтов, типа перевернутого T-кондуита, состоящего из единственной радиальной артерии, анастомозированной со всеми необходимыми коронарными артериями и последующим ее анастомозом с левой внутренней грудной артерией по типу «конец в бок» также используются в настоящее время. Как и с секвенциальным шунтированием, недостатком создания композитных графтов – отсутствие уверенности в безопасности кровоснабжения обширных участков миокарда из одной внутренней грудной артерии. В этой связи необходимо уделять особое внимание профилактике сужения анастомозов, недостаточной длины или натяжения кондуитов и их перекрута.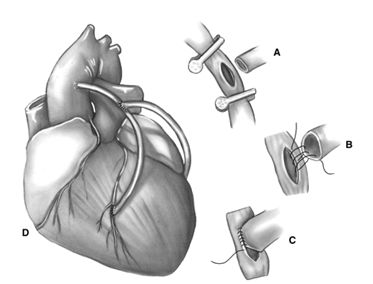
Формирование композитных кондуитов
Устройства для создания проксимальных анастомозов
В настоящее время эти бесшовные приспособления находятся на различных стадиях клинической оценки и коммерческой пригодности. Эти устройства используются для создания аортотомного отверстия и формирования проксимального анастомоза аутовены с восходящей аортой и устраняют потребность в использовании бокового аортального зажима. По некоторым данным они скоро будут также в состоянии соединить и свободные артериальные кондуиты. 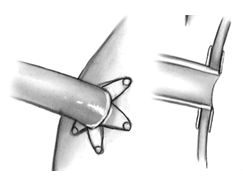
Бесшовный проксимальный коннектор
После того, как все анастомозы завершены прекращается ИК, проводится деканюляция и вводится расчетная доза протамина. Все хирургические анастомозы тщательно проверяются на гемостаз, а артериальные кондуиты по всей их длине. Проводится дренирование перикарда, средостения и вскрытых плевральных полостей. Перикард многие хирурги избегают плотно зашивать во избежание сдавления шунтов. Грудина обычно сшивается Z-швами из нержавеющей стали.
Результаты
Послеоперационная летальность
Послеоперационная летальность после первичного АКШ колеблется от 1% до 5%. Большинство смертельных случаев связано с острой сердечной недостаточностью с- или без связанного с ней инфаркта миокарда. Факторы риска подразделяются на две категории. Первая категория состоит из дооперационных факторов: возраста, сопутствующих заболеваний, степени миокардиальной ишемии и функции, и анатомии. Другую категорию факторов риска составляют год операции, квалификация хирурга, время ИК и ишемии миокарда, полнота реваскуляризации, отказ в использовании внутренней грудной артерии для ПМЖВ, и потребность в фармакологической и механической поддержке сердечной деятельности.
Послеоперационные осложнения
Развитие периоперационного инфаркта миокарда с повышением фракции MB креатинкиназы и/или тропонина I и появлением новых Q-волн на ЭКГ, происходит у 2-5 % пациентов в течение первичного АКШ. Причины инфаркта миокарда включают неадекватную защиту и неполную реваскуляризацию миокарда, технические проблемы с выполнением анастомозов, эмболию, и нестабильность гемодинамики.
Неврологические осложнения могут проявляться в широком диапазоне клинических признаков. Они включают широкий аспект - от тонких нейропсихологических изменений, обнаруживаемых только специфическим обследованием, до серьезного неврологического дефицита. Последний имеет непосредственную связь с возрастом пациента и развивается у 0,5% молодых и 5% пациентов старше 70 лет. Дооперационные факторы риска: гипертония, предшествующие неврологические события и диабет хорошо коррелируют с частотой развития этого осложнения после АКШ.
Осложнения со стороны других органов и систем зависят от дооперационного статуса органа. Например, пациенты с хронической почечной недостаточностью имеют значительно более высокий риск острого трубчатого некроза при ИК, который часто будет требовать временного или постоянного гемодиализа.
Другие медицинские (длительная искусственная вентиляции легких, время пребывания в отделении интенсивной терапии и продолжительность госпитализации) и экономические факторы также учитываются при оценке результатов реваскуляризации миокарда.
Длительность функции шунтов
Комбинация уникальной биологии внутренней грудной артерии и хорошего оттока по передней межжелудочковой ветви левой коронарной артерии обеспечивает чрезвычайно длительную нормальную функцию этого шунта. 10-летняя компетентность кондуита отмечена более чем у 90% пациентов, и есть сообщения о более длительной нормальной функции спустя 15, 20, 25, и 30 лет после операции. Использование внутренней грудной артерии как кондуита для шунтирования других коронарных артерий выявило ее компетентность у 90% больных в течение 5 лет и у 80% - 10 лет.
Правая внутренняя грудная артерия имеет те же показатели функции в отдаленном послеоперационном периоде. Применение внутренней грудной артерии в качестве свободного кондуита также показывает превосходные результаты с нормальной функцией в течение 5 лет у 90% пациентов.
Лучевая артерия в качестве свободного кондуита от аорты нормально функционирует у 85% пациентов в течение в 5 лет. Если она используется как шунт в систему левой коронарной артерии с высоким субкритическим стенозом или в качестве Y-образного композитного графта от левой внутренней грудной артерии срок ее нормальной функции в отдаленном послеоперационном периоде значительно увеличивается.
Хорошая функция желудочно-сальниковой артерии в 5-летнем периоде наблюдения отмечена у 85-90% пациентов, однако опыт ее использования ограничен и крупномасштабные данные недоступны.
Большая подкожная вена обладает значительно меньшими потенциальными возможностями нормальной функции в отличие от артериальных кондуитов. Раннее (в течение первого года) нарушение ее функции происходит в 20-25% и в основном связано с проблемами анастомозов, кинкинга, травмы во время забора и патологии аорты. Позднее нарушение функции венозных кондуитов обусловлено прогрессом коронарного атеросклероза. В течение 5 и 10-летнего периода наблюдения остаются нормально функционирующими соответственно 60% и 40% венозных шунтов. Улучшение их функции в отдаленном послеоперационном периоде может быть достигнуто путем назначения антиагрегантов (аспирин, клопидогрел) и агрессивными антиатеросклеротическим лечением (статины), а также разработкой новых методов обработки венозных кондуитов.
Отдаленные результаты
Долгосрочные результаты могут быть оценены по отсутствию следующих осложнений: возвратная стенокардия, инфаркт миокарда, чрескожная транслюминальная коронарная агниопластика (ЧТКА), реоперация, и смерть. Каждое из этих событий, особенно смерть, может быть стратифицировано на основании до- интра- и послеоперационных условий. 60% пациентов свободны от стенокардии в течение 10 лет, поздний возврат стенокардии обусловлен окклюзией венозных шунтов или прогрессированием нативного коронаросклероза. При этом факторы риска возврата стенокардии не повышают риск смерти. Отсутствие инфаркта миокарда в течение 5 лет после АКШ – 95%, однако повторные инфаркты миокарда неблагоприятно влияют на выживаемость. Отсутствие внезапной смерти составляет 97% в течение 10 лет после АКШ. Сниженная функция левого желудочка – наиболее вероятная причина внезапной смерти. Успешное АКШ не влияет на существование желудочковых аритмий, так как они являются следствием образования рубцовой ткани.
Самым наглядным прогностическим маркером отдаленной выживаемости является дооперационная фракция выброса. Другими, не менее значимым факторами являются полнота реваскуляризации и использование внутренней грудной артерии.
Улучшение качества жизни выражается в увеличении физической работоспособности, особенно у пациентов с полной реваскуляризацией миокарда; улучшается систолическая функция в гипо-, аки- и даже дискинетических областях миокарда. Дооперационная низкая ФВ (<30% ) ограничивает возможность восстановления функции левого желудочка после АКШ.
Сравнительные результаты реваскуляризации миокарда при АКШ и ЧТКА
Сравнительные результаты реваскуляризации миокарда при АКШ и ЧТКА приведены в таблице.
| АКШ | ЧТКА | |||
| EAST | BARI | EAST | BARI | |
| Летальность | 1,3% | 1,0% | 1,1% | 1,0% |
| Q- острый инфаркт миокарда | 4,6% | - | 2,1% | - |
| 3-летняя летальность | 0,8% | 7,1% | 0,2% | 6,3% |
| 5-летняя выживаемость | 89,3% | - | 86,3% | - |
| Реваскуляризация в течение 5 лет | 8% | 9,8% | 54% | 20,2% |
| Выживаемость больных с диабетом | 80,6% | - | 65,5% | - |
На основании нескольких рандомизированных исследований EAST, RITA, CABRI и BARI можно сделать заключение, что в течение 5-летнего периода наблюдения выживаемость, особенно больных с диабетом в группе АКШ выше, чем после РТСА, частота повторной реваскуляризации миокарда в группе ЧТКА значительно превышает этот показатель у больных в группе АКШ.
| Годы | ЧТКА (% пациентов) | АКШ (% пациентов) | Исследование | ||
| Стенокардия | Необходимость в повторной реваскуляризации |
Стенокардия | Необходимость в повторной реваскуляризации |
||
| 1 | 29 | 48 | 12 | - | BARI |
| 1 | 25 | 34 | 15 | 7 | CABRI |
| 2 | 32 | 38 | 22 | 4 | RITA |
| 3 | 20 | 63 | 12 | 14 | EAST |
| 5 | 21 | 52 | 15 | 12,4 | BARI |
| 5 | 49 | 53 | 34 | 12 | RITA |
Еще более наглядным примером различного уровня летальности и частоты реваскуляризации миокарда в двух группах пациентов (ЧТКА и АКШ) в отдаленном послеоперационном периоде приводятся в исследовании Stents or Surgery (SoS, 2001г.), в котором хорошо видно преимущество хирургической реваскуляризации миокарда (см.рис.)
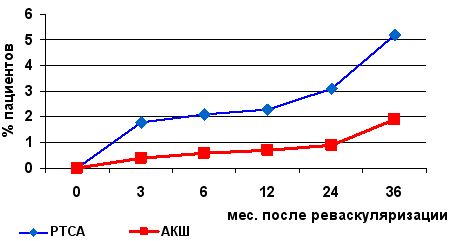
Летальность после ЧТКА и АКШ в отдаленном периоде
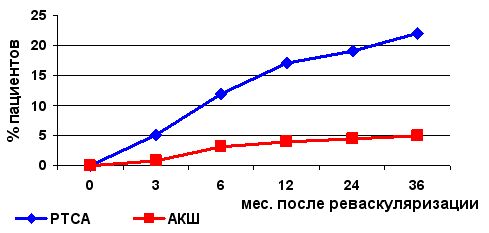
Частота повторной реваскуляризации миокарда после ЧТКА и АКШ в отдаленном периоде
Интересна также оценка экономических затрат на оказание помощи пациентам с ИБС в зависимости от предпочитаемого вида лечения (ЧТКА или АКШ). Сравнение первоначальных затрат на одного пациента и последующих в течение 1, 3 и 7-летнего периода наблюдения показывает, что они в среднем составляют для РТСА 6 000, 10 000, 15 000, 20 000, а для АКШ – 10 000, 13 000, 15 000 и 17 000 долларов США соответственно. Т.е. к седьмому году наблюдения стоимость лечения больного ИБС, которому первоначально использовалась ЧТКА вследствие повторных госпитализаций и вмешательств стала выше, чем у пациентов, которым первоначально использовалось АКШ.
Кроме того, стоимость лечения пациента при хирургической реваскуляризации миокарда напрямую зависит от риска операции.
| Баллы (Euroscore) | 0-3 | 4-7 | 8-10 | >10 |
| Стоимость операции (тыс. долларов США) | 7,8 | 9,9 | 12,6 | 21,4 |
Из таблицы видно, что цена операции возрастает в 3 раза при таком же росте риска операции. Последнее обстоятельство настоятельно рекомендует проводить АКШ, не дожидаясь развития тяжелых осложнений, добиваясь при этом улучшения качества и одновременно снижая стоимость лечения.
ИБС является самым распространенным заболеванием индустриальной цивилизации. АКШ – наиболее часто выполняемая операция в мире, считающаяся золотым стандартом для лечения пациентов с коронарной болезнью. ИК в настоящее время используется приблизительно в 80% первичных операций АКШ. В то же время появление новых технологических устройств, робототехники и возможности выполнения операций на работающем сердце будут во многом менять многие аспекты этой операции.
Операции аортокоронарного шунтирования (АКШ) в Беларуси - европейское качество за разумную цену.
Профессор, доктор медицинских наук Ю.П. Островский


