
В начале 1970-ых А.Gruentzig предложил технику - чрескожной внутрисосудистой ангиопластики. Этот метод восстановления проходимости сосудов использовался сначала на периферических артериях, а затем с 1977 г. – на коронарных артериях - чрескожная транслюминальная коронарная ангиопластика (ЧТКА).
Решение выполнять процедуру ангиопластики должно быть основано на тщательной оценке нескольких факторов, включая историю болезни пациента, степень поражения сосуда, анатомических особенностей и риска вмешательства. Для этого важно хорошо понимать тенденции в эндоваскулярной хирургии — как методы развиваются, лучше всего используются в сравнении с другими стратегиями.
Тромболизис
Тромболитическая терапия острого инфаркта миокарда появилась в 1970-ых с наблюдения Rentrop, показавшим что внутрикоронарное введение стрептокиназы обеспечило эффективный тромболизис инфаркт-зависимой артерии. С середины 1980-ых, внутривенная тромболитическая терапия начала широко применяться в клинике, поскольку было доказано, что своевременная назначение тромболитических средств уменьшает размер инфаркта, сохраняет функцию левого желудочка, и улучшает выживаемость пациентов с острым инфарктом миокарда. Тромболитические средства активируют превращение профибринолизина в активный фермент плазмин, который растворяет компонент фибрина в тромбе. Они могут быть разделены на две группы — специфические и неспецифические активаторы фибринолиза. Первая включает тканевые активаторы плазминогена и их производные, вторая – неспецифические протеазы: стрептокиназу (SK), урокиназу (UK) и анистреплазу (APSAC).
Несмотря на неопровержимое свидетельство эффективности этого метода, до настоящего времени остаются спорными проблемы выбора определенного препарата, потребность в дополнительной терапии, включая антагонисты IIb/IIIa рецепторов тромбоцитов или других антиагрегантов и низкомолекулярных гепаринов.
Стрептокиназа - тромболитический белок, который преобразовывает профибринолизин в плазмин. Как продукт β-гемолитического стрептококка стрептокиназа может привести к аллергическим реакциям, особенно у пациентов с недавними стрептококковыми инфекциями. Рекомендованная доза - 1,5 миллиона единиц обычно достаточна, чтобы преодолеть эффект нейтрализации антител и привести к системному фибринолизу. Период полувыведения стрептокиназы - 30 минут, но снижение уровня фибриногена обычно длится в течение 24 часов. Антитела развиваются спустя 4 суток после введения препарата и сохраняются в течение 6 месяцев, поэтому не рекомендуется, повторно использовать стрептокиназу в течение этого времени.
Тканевые активаторы плазминогена (t-PA) - естественная серин-протеаза, которая является неаллергенной и может использоваться повторно. В отличие от стрептокиназы она является относительно специфичной для фибрина и больше подходит для местного тромболизиса. Период полувыведения препарата составляет 5 минут. Первоначально рекомендованная доза - 100 мг за 3-часовой период (60, 20, и 20 мг за 1, 2, и 3 часы соответственно). В последующем предложена ускоренная схема введения t-PA: болюсом 15 мг и повторно 50 мг в первые 30 минут, и остаток (35 мг) за следующие 60 минут. Этой дозой достигается снижение в фибриногена на 50%, вследствие чего образуется меньше продуктов деградации фибриногена. Геморрагические осложнения отмечены только у больных с небольшой поверхностью тела (< 1,65 м2). В сравнении со стретокиназой t-PA более эффективен, как тромболитический препарат, но является в 5-10 раз более дорогостоящим.
APSAC - активный ферментативный участок профибринолизина стрептокиназы, защищенный ацилированием, имеет продленное фибринолитическое действие (период полувыведения 90 минут). и может быстро вводится внутривенно. Весь болюс препарата вводится в течение 2-5 минут. APSAC не превосходит другие препараты в улучшении желудочковой функции или снижения смертности.
Урокиназа - протеолитический фермент, произведенный из эмбриональной почечной ткани человека. Доза вводится болюсом 1,5 миллионов единиц с последующим назначением еще 1,5 миллионов ед. в течение часа. Клинические исследования показали, что после внутривенного введения урокиназы тромболизис наступает у 50-70% больных. По сравнению со стрептокиназой урокиназа намного менее аллергена.
Показания
Все пациенты с острым инфарктом миокарда являются кандидатами на внутривенную тромболитическую терапию, если после появления признаков инфаркта прошло меньше 6 часов и отсутствуют потенциальные источники возможного кровотечения. Поскольку степень миокардиального повреждения зависит от фактора времени, наибольшее снижение смертности отмечено у пациентов с максимально ранним использованием тромболитических средств, хотя благоприятное влияние доказано и при более позднем (спустя 12 часов) начале лечения. Пациенты с системной артериальной гипертнзией, так же как и больные в возрасте старше 75 лет, имеют увеличенный риск внутричерепного кровоизлияния и других геморрагических осложнений. Кроме того, больным с депрессией ST- сегмента тромболитическая терапия может фактически быть вредной. В этой связи указанным группам пациентов проведение тромболизиса противопоказано.
Исследование Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries (GUSTO-I) показало, что более высокая летальность после проведения тромболизиса отмечена у больных с низким артериальным давлением, высоким классом Killip, учащенным ритмом, передним инфарктом и возрастом более 75 лет. Эти 5 факторов на 90% определяют прогноз. Независимо от вида тромболитического препарата, 30-дневная летальность была существенно ниже (4,4% против 8,9%), чем у пациентов с нераскрытой связанной с инфарктом артерией.
Ангиопластика и тромболитическая терапия
Чрескожная транслюминальная коронарная ангиопластика (ЧТКА) часто выполняется у пациентов с острым Q инфарктом миокарда после тромболитической терапии или вместо тромболизиса. По результатам Thrombolysis and Angioplasty in Myocardial Infarction (TAMI) исследования было показано, что агрессивная терапия после внутривенной тромболитической терапии с рекомбинантным активатором профибринолизина не привела к ожидаемому улучшению функции левого желудочка и выживаемости. Более того, агрессивный подход был связан с большим количеством осложнений и летальностью. Другие исследования выявили, что первичная ЧТКА может быть более предпочтительна, чем тромболитическая терапия в лечении острого инфаркта миокарда, так как снижает частоту повторного инфаркта миокарда, внутричерепного кровоизлияния и смерти. Однако, согласно принятой медицинской практике, для коронарной ангиопластики требуется наличие опытной хирургической бригады в пределах учреждения для выполнения при необходимости аортокоронарного шунтирования.
Последние работы Stone с соавт. показали, что использование стентов с или без использования абциксимаба, превосходит ЧТКА при лечении острых инфарктов миокарда с подъемом ST-сегмента. В течение 6-месячного периода наблюдения смерть повторный инфаркт миокарда или реваскуляризация миокарда отмечены у 20% пациентов после ЧТКА, 16,5% после сочетанного применения ЧТКА и абциксимаба, 11,5% после стентирования и у 10% после стентирования и использования игибитора IIb\IIIa рецепторов тромбоцитов (p <.001). Рестеноз ангиографически выявлен у 40,8% после ЧТКА и 22% после стентирования (p <.001). Госпитальная летальность после тромболизиса у женщин была в 3,3 больше, чем у мужчин (9,3% против 2,8%, p = .005). Напротив, после первичной чрескожной транслюминальной коронарной ангиопластики, женщины и мужчины имели приблизительно одинаковую госпитальную летальность (4,0% против 2,1%, соответственно). Объединенные данные трех рандомизированных исследований предполалагают, что первичная ангиопластика может уменьшить смертность на 63% без увеличения стоимости лечения.
Первоначально чрескожная транслюминальная коронарная ангиопластика использовалась при поражении одной коронарной артерии при неэффективности терапии. В настоящее время показания значительно расширились она успешно применяется у больных с многососудистым поражением, стенозом ствола левой коронарной артерии, как первичная терапия для пациентов с острым инфарктом миокарда с подъемом ST-сегмента и при остром инфаркте миокарда с зубцом Q.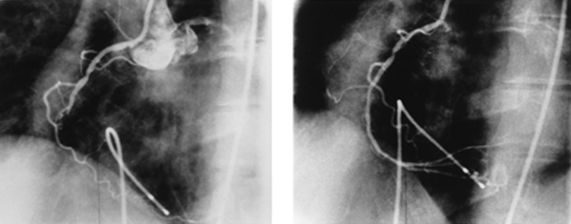
Острый инфаркт миокарда с окклюзией правой коронарной артерии и результат ангиопластики
Решение использовать ЧТКА или стентирование зависит от нескольких критериев: классификации повреждения, числа стенозов и пораженных артерий и клинического статуса пациента. Американская ассоциация кардиологов и Американская ассоциация сердца приняли систему классификации для пациентов, подвергающихся ЧТКА, основанную на вероятности успешного выполнения процедуры.
| Характеристика поражений типа A, B, и C |
| Тип А (минимально сложный) |
| Дискретный (длина <10 мм) |
| Концентрический |
| Хорошо доступный |
| Отсутствие или изгиб <45° |
| Гладкий контур |
| Небольшой или отсутствие кальциноза |
| Неполностью окклюзирующий |
| Расположенный вне устья |
| Не вовлекающий боковые ветви |
| Отсутствие тромба |
| Тип В (умеренно сложный) |
| Трубчатый (длина 10-20 мм) |
| Эксцентричный |
| Умеренная извилистость проксимального сегмента |
| Умеренный изгиб > 45° <90° |
| Негладкий контур |
| Умеренный или тяжелый кальциноз |
| Окклюзия более 3-х месяцев |
| Локализация в устье |
| Бифуркационный, требующий использования двойного проводника |
| Наличие тромба |
| Тип C (особо сложный) |
| Диффузный (длина > 2 см) |
| Чрезмерная извилистость прокимального сегмента |
| Выраженный изгиб > 90 ° |
| Полная окклюзия более 3-х месяцев и\или наличие коллатералей |
| Невозможность защитить главные боковые ветви |
| Дегенеративные венозные шунты с рыхлыми повреждениями |
Кроме того, Ryan TJ, совместно с Американским комитетом по ЧТКА в 1993 г. предложили выделить следующие факторы, прогнозирующие неблагоприятные исходы чрескожной транслюминальной ангиопластики и стентирования.
Факторы, прогнозирующие внезапную окклюзию сосуда, повышающие летальность при чрескожной транслюминальной ангиопластики и стентировании
| До ЧТКА | После ЧТКА |
|---|---|
| Клинические факторы: | Диссекция интимы >10 мм |
| Женский пол | Остаточный стеноз >50% |
| Нестабильная стенокардия | Преходящая окклюзия |
| Инсулин-зависимый диабет | Остаточный трансстенотический градиент 20 мм рт.ст. |
| Неадекватная антиагрегантная терапия | |
| Ангиографические факторы: | |
| Интракоронарный тромб | |
| Стеноз >90% | |
| Длина стеноза в 2 раза > диметра сосуда | |
| Стеноз в области боковой ветви | |
| Стеноз в области изгиба 45° | |
| Стеноз правой коронарной артерии |
Показания к выполнению ангиопластики и стентирования
Таким образом, в соответствии с классификацией приоритетности выбора метода лечения, сформированы показания к выполнению ангиопластики и стентирования.
Показания для выполнения чрескожного коронарного вмешательства у больных с бессимптомной ишемической болезнью сердца и стабильной стенокардией
Класс І
- пациенты, не получающие лечение по поводу диабета, с бессимптомной ишемией или стенокардией I функционального класса, имеющие ≥ 1 значительных стеноза в 1-2 коронарных артериях, доступных для ангиопластики, у которых высока вероятность успешного результата и низкий риск осложнений (смерти). Сосуд, который планируется дилатировать должен кровоснабжать значительную массу жизнеспособного миокарда.
Класс ІІA
- те же клинические и анатомические критерии, что для класса І, за исключением того, что сосуд кровоснабжает среднюю массу миокарда или пациент имеет диабет, требующий лечения.
Класс ІІB
- пациенты с бессимптомной ишемией или стенокардией I функционального класса, имеющие 2-3 стеноза коронарных артерий, доступных для чрескожного коронарного вмешательства, высокую вероятность успешной дилатации и низкий риск осложнений. Стенозированные сосуды, которые планируется дилатировать, должны кровоснабжать по крайней мере умеренную по величине массу жизнеспособного миокарда. Должны быть объективные свидетельства ишемии миокарда по данным нагрузочного теста с электрокардиографией, суточного мониторирования электрокардиограммы, радиоизотопного или ультразвукового исследования.
Класс ІІІ
- пациенты с бессимптомной ишемической болезнью сердца или стенокардией I функционального класса, у которых отсутствуют критерии, перечисленные для классов І и ІІ, и которые имеют:
- отсутствуют объективные признаки ишемии миокарда;
- стенозы имеют низкую вероятность успешной дилатации;
- незначительные боли в грудной клетке, маловероятно вызванные ишемией миокарда;
- факторы, обуславливающие высокую частоту осложнений (высокую заболеваемость и смертность);
- незначительные стенозы коронарных артерий < 50%.
Показания для проведения ангиопластики после тромболизиса
Класс І
- при наличии объективных свидетельств рецидивирующего инфаркта миокарда или ишемии (спасительная ангиопластика).
Класс ІІA
- кардиогенный шок или гемодинамическая нестабильность.
Класс ІІB
- рецидивирующая стенокардия без объективных признаков ишемии/инфаркта;
- ангиопластика стеноза на инфаркт-связанной артерии в течение 48 часов после успешного тромболизиса у бессимптомных пациентов, которые в настоящее время не имеют клинических и/или индуцируемых признаков ишемии миокарда.
Класс ІІІ
- рутинная ангиопластика в течение 48 часов после неуспешного тромболизиса;
- рутинная ангиопластика стеноза инфаркт-связанной артерии немедленно после тромболитической терапии.
Показания для выполнения ангиопластики у пациентов после предшествующего аортокоронарного шунтирования
У части больных с рецидивом стенокардии после проведенного ранее шунтирования симптомы стенокардии могут быть в значительной степени уменьшены при помощи стентирования шунтов специальными стентами.
Класс І
- пациенты с ранним рецидивом ишемии (обычно в течение 30 дней) после аортокоронарного шунтирования.
Класс ІІA
- пациенты с ишемией, возникшей в течение 1-3 лет после операции при наличии сохранной функции левого желудочка и отдельных (недиффузных) стенозов в шунтах;
- инвалидизирующая стенокардия (III-IV функциональный класс) вследствие новых стенозов в собственных коронарных артериях. Если проявлением ишемии является атипичная стенокардия, то требуется объективное подтверждение тяжести ишемии;
- пациенты со значительными стенозами венозных шунтов через 3 года и более после аортокоронарного шунтирования.
Класс ІІІ
- ангиопластика хронической полной окклюзии венозного шунта.
- пациенты с многососудистым поражением или окклюзией множественных венозных шунтов и нарушенной функцией левого желудочка.
Однососудистое поражение
Пациенты с болезнью одной коронарной артерии - все еще одна из наибольших групп, подвергающихся ангиопластике. В этой группе пациентов, успех достигается у 90-95% пациентов. Исследование Affairs Angioplasty Compared with Medical Therapy (ACME) показало, что ЧТКА предлагает более раннее и более полное избавление от стенокардии, чем медикаментозная терапия.
Недостатки чрескожной транслюминальной ангиопластики - начальные более высокие затраты и более высокая потребность в повторной процедуре. Использование стентов улучшило эффективность ангиопластики, уменьшило частоту возникновение рестеноза, требующего повторного вмешательства до 15-20%. Еще позже, использование "покрытого" рапамицином стента (Sirolimus) уменьшило риск развития рестеноза до 5%.
Многососудистое поражение
Роль ангиопластики в последнее время увеличивается, однако нет абсолютных доказательств ее преимущества перед хирургической реваскуляризаций миокарда.. Коронарная хирургия предполагает более полную реваскуляризацию независимо от коронарной анатомии, но более рискованна, из-за вынужденного использования общей анестезии, механической вентиляции легких, искусственного кровообращения и длительного периода реабилитации. Чрескожная транслюминальная коронарная ангиопластика напротив, имеет более высокий риск острой окклюзии артерии и ранних рестенозов и не гарантирует полную реваскуляризацию во время процедуры. Как отмечено выше, использование покрытых стентов с течением времени сделают ЧТКА еще более привлекательным методом реваскуляризации миокарда. Рандомизированные исследования, сравнивающие результаты коронарной ангиопластики и АКШ показали, что чрескожная транслюминальная коронарная ангиопластика не столь же эффективна в долгосрочной перспективе, как хирургия и часто требует повторной ангиопластики или хирургии. Покрытый стент может увеличить эффективность ЧТКА, позволяя ее более успешное использоваться с лучшими долгосрочными результатами у большого количества пациентов с многососудистым поражением. Определяющими критериями преимущества различных способов реваскуляризации являются функциональный статус, качество жизни, трудоспобность пациента и затраты здравоохранения.
По результатам исследований Bypass Angioplasty Revascularization Investigation (BARI), Randomized Intervention Treatment of Angina (RITA), German Angioplasty Bypass Surgery Investigation (GABI) исследований не было выявлено существенных различий между ЧТКА и АКШ в выживаемости больных. Повторная реваскуляризация, инфаркт миокарда, и смерть были более обычны среди пациентов ЧТКА (38%) по сравнению с хирургической группой больных (11%), а повторная коронарная ангиография в четыре раза чаще проводилась у пациентов ЧТКА (31% против 7%). По данным Coronary Artery Bypass Revascularization Investigation (CABRI) повторная реваскуляризация оказалась выше в группе PTCA - 11,4 % против 1,1 %.
Осложнения ангиопластики
Процедурный успех в ангиопластике зависит от возраста, пола и клинических данных (наличие диабета, предшествующего инфаркта миокарда или АКШ и сниженной функции левого желудочка). Прогнозом также являются ангиографические особенности стеноза. Риск острой окклюзии коронарной артерии и раннего рестеноза должен быть тщательно взвешен.
Острая окклюзия сосуда
Острая ишемия может развиться у 3-7% пациентов, подвергающихся коронарной ангиопластике. Больше чем у половины этих пациентов основной причиной окклюзии являются диссекция интимы и тромбоз. Прогнозом этого осложнения являются мягкая бляшка, de novo стеноз, повышенная извилистость сосуда, кальциноз, большая протяженность и степень (80-99%) стеноза, дегенеративные изменения стенки вены, т.е. изменения в коронарных артериях, отнесенных к поражениям типа В и С.
Несмотря на различные способы профилактики, используемые для предотвращения острой окклюзии, развитие этого осложнения часто остается непредсказуемым. Использование стентов снизило частоту окклюзии до 1,8% по сравнению с стандартной ангиопластикой. Большинство клиник для профилактики тромбозов коронарных артерий применяет аспирин в комбинации с клопидогрелем до- и после ЧТКА и гепарин в течение 12-24 часов после ангиопластики. У пациентов с высоким риском окклюзии получило широкое распространение использование ингибитора IIb/IIIa рецепторов тромбоцитов. Внутрикоронарная визуализация внутрисосудистым ультразвуком может помочь выявить важные особенности, которые идентифицируют повреждения опасные для развития острой окклюзии.
Рестеноз
Рестеноз может быть описан как хроническое повторное сужение расширенного сосуда в ответ на воздействие баллона или стента, которое происходит в течение 3-6 месяцев после процедуры. В 1992 среднее число рестенозов составляло 30%. Последовательная ангиографическая оценка после успешной ЧТКА показала, что у 11% пациентов рестеноз развивался в течение первого месяца, у 39% - в конце первых 3 месяцев и дополнительно 6% больных будут иметь рестеноз спустя 3-6 месяцев после ангиопластики.
Повторное сужение в течение первых нескольких дней после того, как процедура ангиопластики завершена, обычно оценивается как острая окклюзия, часто вызываемая тромбозом вследствие диссекции интимы. Некоторые исследования показали, что приблизительно 25% пациентов несмотря на развитие рестеноза остаются бессимптомными. Примечательным фактом является то, что среди больных с рецидивом стенокардии до 44 %, не имеют рестеноза.
Несмотря на то, что рестеноз не приводит к увеличению смертности (у пациентов с рестенозом развивается стенокардия, а не инфаркт миокарда или внезапная смерть), появление этого осложнение ведет к необходимости повторной реваскуляризации, и, таким образом, увеличивает заболеваемость и затраты. Использование стентов уменьшило риск рестеноза на 30-50%, а применение рапамицин-покрытых стентов привело к снижению частоты рестеноза до 5% в течение первого года после процедуры.
Механизм рестеноза
Рестеноз является местным сосудистым проявлением общего ответа на повреждения эндотелия. В течение нескольких секунд после ангиопластики или имплантации стента развивается повреждение, привходящее к гибели эндотелиальных клеток, переастяжению и разрыву гладких мышц стенки коронарной артерии. В течение следующих нескольких минут после этого происходит фиксация тромбоцитов к месту повреждения и местная стимуляция коагуляционного каскада. В течение нескольких дней после процедуры происходит пролиферация эндотелия, гладких мышц и миграция макрофагов. Через несколько недель происходит синтез, созревание и сокращение внеклеточной матрицы и формирование повторного сужения сосуда.
Артериальное ремоделирование
Согласно Currier и Faxon о рестенозе можно думать не просто как о формировании неоинтимы, но и как артериальном ремоделировании. Компенсационная дилатация и хроническое сужение представляют два аспекта артериальной модернизации в ответ на ангиопластику. В этой связи терапевтическая стратегия изменяющая артериальное ремоделирование в сочетании с предотвращением формировании неоинтимы может уменьшать развития рестеноза после коронарных вмешательств.
Профилактика рестенозов
Использование ангиографии, чтобы предсказать долгосрочный успех или отказ от ЧТКА имеет ограниченную ценность, так как эти изображения обеспечивают только ограниченную визуализацию артериального просвета и не дают представления о морфологических особенностях атеросклеротической бляшки. Внутрисосудистый ультразвук используется с большим успехом, так как обеспечивает информацию о морфологических особенностях атеромы и ее состава и вследствие этого интервенционная стратегия может быть изменена для достижения оптимального результата.
Раневой процесс после ангиопластики начинается в течение минут или спустя 2 часа после процедуры и может продолжаться в течение многих недель или месяцев. Этот процесс зависит от выброса цитокинов и стимуляции факторов роста. Поэтому терапия должна быть направлена как уменьшение раннего воспалительного процесса, так и поздней пролиферативной реакции. Применение липид-снижающей терапии не в состоянии уменьшить риск рестеноза.
Ингибиторы тромбоцитов
Изменение потока крови после ангиопластики, происходит в результате агрегации тромбоцитов на участках повреждения эндотелия, поэтому пациентам обычно назначаются аспирин, нитраты, антагонисты кальция и гепарин. Согласно результатам исследования Prevention of Ischemia Complications (EPIC) ингибиторы тромбоцитов (абциксимаб) способны снизить частоту рестенозов, так как блокируют гликопротеин IIb/IIIa рецепторы тромбоцитов, препятствуя их агрегации. Однако при этом увеличивается количество геморрагических осложнений
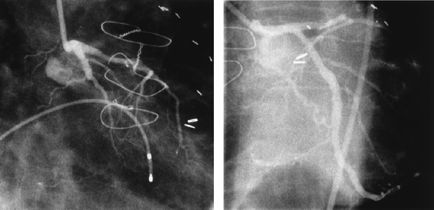
Острый инфаркт миокарда боковой стенки левого желудочка и результат прямой с имплантацией стентов и использованием абциксимаба
Последние исследования показали, что определенные типы стенозов можно более эффективно лечить другими более новыми технологиями, типа внутрисосудистых стентов атероэктомией и т.д.. Эти устройства, более эффективны чем обычная ангиопластика в лечении кальцинированного, эксцентричного или устьевого стеноза.
Коронарное стентирование
Стимулом к использованию сосудистых эндопротезов или стентов стало достаточно большое количество осложнений при выполнении чрескожной коронарной ангиопластики. В 1986 г. во Jaquеs Puel провел первую имплантацию коронарного стента. В течение последующих десятилетий появилось большое количество модификаций и конструкций стентов.

Модификации современных интракоронарных стентов
Факторами, определяющими необходимость имплантации стента, являются диссекция интимы, острая окклюзия, остаточный стеноз или тромбоз коронарной артерии, рестеноз. Опыт последних лет показывает, что стентирование может быть привилегированной терапией острого инфаркта миокарда с подъемом ST-сегмента или без подъема ST-сегмента, но с повышенным уровнем тропонина I. Увеличивается частота применения стентов и при Q-инфаркте миокарда. 
Стент на баллоне в закрытом и открытом положении
Модификации стентов
В настоящее время все разновидности стентов подразделяются на две больших группы – пассивные и активные. Первая группа стентов представляет собой каркас из нержавеющей стали марки 316 L с толщиной металлической нити 130-140 мкм без какого-либо покрытия. Частота внутристеновых рестенозов составляет 13-16% в год. Вторая группа представлена покрытыми стентами, для чего используется паклитаксел (действующее вещество из группы токсинов, полученных экстрагированием их коры тисового дерева TAXUS brevifolia), который способствует полимеризации тубулина в стабильные микротрубочки и блокирует клеточный цикл в фазе М. Другим препаратом является рапамицин, блокирующий клеточный цикл в фазе G1 (стент CYPHER). Такое воздействие значительно снижает воспалительную реакция в месте имплантации стента и уменьшает частоту рестенозов до 4-8% в год.
TAXUS, изготавливающихся на основе стентов EXPRESS, а стенты CYPHER – на основе BxVelocity. Для фиксации действующего вещества используются полимерные носители. Полимер, использующийся в стентах TAXUS, является нерассасывающимся эластомером матричного типа, который обеспечивает более медленное высвобождение препарата, чем полимер, использующийся в стентах CYPHER. Через 8 дней с поверхности стента CYPHER высвобождается половина препарата, а через 30 дней – 4/5 всей дозы. При этом 1/5 дозы препарата остается на поверхности стента, в то время как стенты TAXUS обеспечивают высвобождение лишь небольшой дозы препарата, при этом большая его часть остается связанной с полимером. Ретроспективный анализ и рандомизированные исследования не выявили достоверных различий между результатами использования стентов TAXUS и CYPHER (по показателям летальности и частоты инфаркта миокарда).
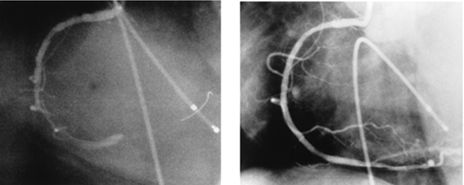
Диссекция интимы правой коронарной артерии после ангиопластики и восстановление проходимости артерии после имплантации стентов
Стентирование огибающей ветви левой коронарной артерии
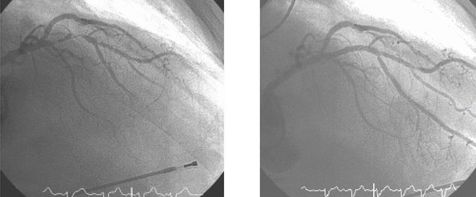
Стентирование передней межжелудочковой ветви левой коронарной артерии
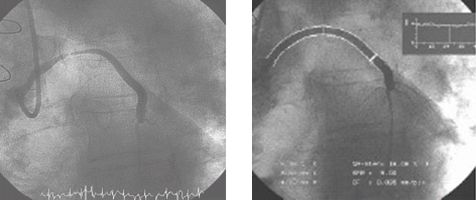
Стентирование аутовенозного шунта в переднюю межжелудочковую ветвь левой коронарной артерии
Проблема тромбоза, связанного с ангиопластикой не решается с помощью использования стента, так как последний сам обладает тромбогенными свойствами и требует специальной терапии. Исследование BENESTENT II, в котором оценивались результаты стентирования гепарин- и рапамицин-покрытых стентов показали, что в целях профилактики ранних тромбозов стентов необходимо применение антиагрегантов. В клинической практике оптимальным признано сочетание аспирина с клопидогрелем. Комбинированная антитромбоцитарная терапия позволяет предотвратить острый/подострый тромбоз стента. В качестве альтернативы клопидогрелю можно использовать его предшественник – тиклопидин (тиклид).
Ацетилсалициловия кислота – (аспирин): 325 мг внутрь однократно, затем в дозе 75-160 мг/сут неопределенно долго.
Клопидогрель (плавикс): первый прием – 300 мг однократно (т.е. 4 таблетки) за 6 часов до стентирования. Первую дозу можно увеличить до 600 мг при необходимости экстренного выполнения ангиопластики (для скорейшего наступления эффекта). Далее пациент продолжает принимать препарат в дозе 75 мг/сутки в течение 1 месяца (и вплоть до 9-12 месяцев) в сочетании с аспирином. Через 7-10 дней от момента начала терапии следует выполнить общий анализ крови с подсчетом количества тромбоцитов.
Тиклопидин (тиклид): при проведении плановой ангиопластики прием начинают за несколько дней (3-5 дней) до процедуры в дозе 250 мг х 2 раза в сутки, т.к. для развития эффекта требуется несколько суток. Затем пациент принимает тиклопидин (250 мг 2 раза/сутки) в сочетании с аспирином 75-160 мг/сутки на протяжении 1 месяца, а затем – изолированный прием аспирина. Тиклопидин может вызвать снижение уровня лейкоцитов и тромбоцитов. Поэтому на фоне приема тиклопидина следует периодически выполнять общий анализ крови с подсчетом количества тромбоцитов (каждые 7-10 дней).
Одно из редких осложнений - потеря стента с системы доставки в периферическое сосудистое русло. В таких случаях ЯМР-томография может быть полезным исследованием для определения местонахождение устройства. Другим моментом является более высокая стоимость лечения при стентировании по сравнению ангиопластикой. Исследование Stent Re-Stenosis Study (STRESS) показало, что полное 1-летнее медицинское обслуживание пациента стоит приблизительно на $800 дороже по сравнению с обычной ангиопластикой. Продолжающееся совершенствование дизайна стентов и их обработки, режимов антикоагуляции могут снизить это различие стоимости и уменьшить стент-связанные сосудистые осложнения и длительность лечения.
Прямая коронарная атерэктомия
Прямая коронарная атерэктомия была предложена в 1986 г. как альтернатива чрескожной коронарной ангиопластике. Цель – уменьшение объема атеросклеротической бляшки для восстановления проходимости коронарной артерии. Для этого используется специальное устройство в виде металлического цилиндра с боковым окном, располагающимся на кончике катетера. Устройство подводится к бляшке и вращающийся нож вырезает атероматозный материал с последующим его размещением в металлическом цилиндре.
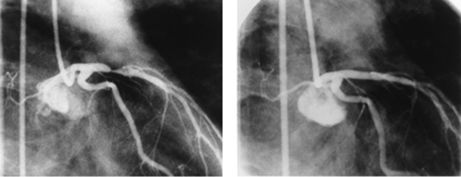
Прямая атерэктомия из проксимального сегмента передней межжелудочковой ветви левой коронарной артерии
Клинический и ангиографический результат после атерэктомии достигается у 86% больных. Исследование Coronary Angioplasty Versus Excisional Atherectomy Trial (CAVEAT I), однако, показало, что этот метод недостаточно восстанавливает проходимость коронарных артерий, часто требует добавочной ангиопластики и имеет более высокую частоту не-Q инфарктов миокарда и рестенозов и, как следствие, не дает никакого преимущества перед обычной ЧТКА. Оценка непосредственных и отдаленных результатов прямой атерэктомии и стентирования у женщин и пожилых показало, что оба метода могут быть благополучно и эффективно выполнены у этой категории пациентов, несмотря на несколько более низкую частоту успеха и большее количество острых осложнений по сравнению другой когортой пациентов.
Ротационная аблация
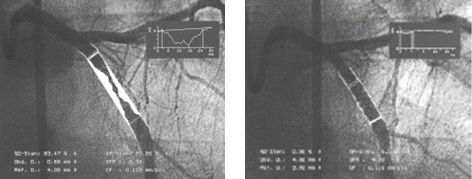
Ротаблатор - высокоскоростной бур, имеющий форму маслины и покрытый алмазной крошкой, предназначен для восстановления проходимости артерий с атеросклеротическими кальцинированными бляшками. При введении устройства к области поражения коронарной артерии эллипсовидная часть головки катетера вращающаяся со скоростью 180 000 оборотов в минуту, размалывает атерому на миллионы крошечных фрагментов. В отличие от прямой атерэктомии, ротаблация позволяет разрушить бляшку на месте. Первичный успех достигается в 95% случаев, однако у большинства пациентов необходима сопутствующая ангиопластика для достижения оптимального диаметра сосуда. Противопоказаниями для использования метода являются тромбоз и повышенная ангуляция коронарной артерии.
Ротаблатор и ротационная абляция атеросклеротической бляшки из коронарной артерии
По данным Multicenter Rotablator Registry была проанализирована эффективность ротационной атерэктомии при устранении 1 078 кальцинированных и 1 083 некальцинированных повреждений. Добавочная коронарная ангиопластика использовалась при устранении 82,9% кальцинированных и 66,9% некальцинированных бляшек. Процедурный успех (определенный как менее чем 50%-ый остаточный стеноз без главных осложнений) был достигнут в 94,3% кальцинированных и 95,2% некальцинированных повреждений. Таким образом, успех ротаблации не снижался несмотря на более сложную природу кальцинированных стенозов, что говорит потенциале ротационной атерэктомии как метода выбора для устранения сложных кальцинированных стенозов.
Брахитерпия
Использование местной радиотерапии с β и γ эмитентами (иридий-192, стронций-90, иттрий-90) показало возможность снижения риска внутристентовых рестенозов в течение первого года после процедуры до 5-15%. В последующем были выявлены такие проблемы, как краевые рестенозы, рестенозы в отдаленных от центра облученной зоны местах коронарных артерий, позднее развитие тромбоза, коронарных аневризм и псевдоаневризм. В этой связи рекомендовалась длительная (боле года) терапия антиагрегантами, включая аспирин и клопидогрель. Продолжит ли эта форма терапии использоваться, если покрытые стенты (типа рапамицин-покрытого стента) оказываются более эффективными в лечении атеросклеротических стенотических поражений, покажет будущее. Однако, ограниченная радиотерапия будет полезным дополнением даже в эру использования покрытых стентов.
Коронарная ангиопластика наряду со стентированием остается краеугольным камнем интервенционной кардиологии, составляя больше чем 90% всех коронарных вмешательств. Если результаты использования рапамицин-покрытых стентов окажутся столь же успешными, какими они являются в настоящее время, будущее воздействие интервенционной кардиологии в лечении коронарного атеросклероза будет еще больше. Стентирование, вероятно, останется первичной процедурой для коронарных вмешательств и стандартом, с которым будет необходимо сравнивать новые технологии лечения ИБС.
Профессор, доктор медицинских наук Ю.П. Островский


