 Под термином инфекционный эндокардит подразумевают любую инфекцию, поражающую эндокард, сердечные клапаны, эндотелий прилежащих сосудов, а также другие внутренние органы (почки, печень, селезенку и др).
Под термином инфекционный эндокардит подразумевают любую инфекцию, поражающую эндокард, сердечные клапаны, эндотелий прилежащих сосудов, а также другие внутренние органы (почки, печень, селезенку и др).
Некоторые авторы указывают, что точная цифра заболеваемости инфекционным эндокардитом неизвестна.
Некоторые авторы указывают, что точная цифра заболеваемости инфекционным эндокардитом неизвестна. В то же время в США приходится 0,16-5,4 случаев инфекционного эндокардита на 1000 госпитализаций, во Франции отмечается 18 заболеваний на миллион жителей (970 человек в год), четверть из которых лечится хирургическим путем.
Протезный эндокардит, возникающий на искусственных клапанах сердца, встречается у 1-13% больных. Благополучной считается ситуация, если частота возникновения протезного эндокардита в кардиохирургическом центре не превышает 2% среди оперированных больных без предшествующего инфекционного поражения клапанов сердца.
В целом заболеваемость инфекционным эндокардитом увеличивается. Это происходит за счет роста числа пациентов с дегенеративными, атеросклеротическими, травматическими поражениями клапанов сердца, увеличением числа пациентов с механическими и биологическими протезами, а также искусственными водителями ритма. Возрастает количество больных инфекционным эндокардитом, не имевших клапанной патологии и заболевших вследствие длительных внутривенных инфузий, наркомании, гемодиализа, применения химио- и стероидной терапии, воздействия факторов неблагоприятной экологической среды. Отечественные авторы отмечают особую роль ревматических пороков сердца, как субстрата для развития инфекционного эндокардита.
История
Первое описание больных, погибших от инфекционного эндокардита, произвел А.Riviere в 1646 г. Термин эндокардит был введен в 1834 г. F.Buyo. Клапанные вегетации впервые описал R. Wirchow в 1846 г., а в 1872 г. S.Winge, H.Heiberg доказали микробную этиологию эндокардита. В 1885 г. W.Osler впервые описал симптоматику, клиническое течение и морфологические особенности этого заболевания. До появления антибиотиков большинство больных умирало от неконтролируемой инфекции и только 12% - от сердечной недостаточности. Применение сульфаниламидов в 1937 г. привело к излечению 15% больных.
Революцией в лечении инфекционного эндокардита стало внедрение пенициллина. Впервые парентеральное введение пенициллина у больного с инфекционным эндокардитом применил в 1940 г. Henry Dawson. Он излечил инфекционный процесс на клапанах сердца подкожными инъекциями пенициллина в течении 2 дней. В 1944 г. A.Loewe впервые применил внутривенное введение пенициллина, добившись 100% выздоровления 7 пациентов с инфекционным эндокардит. В настоящее время около 80% больных может быть успешно излечено с помощью антибиотикотерапии.
Однако у 20% пациентов лекарственное лечение оказывается безуспешным, так как основной причиной смерти становится сердечная недостаточность вследствие пороков клапанов сердца. Поэтому следующей вехой явилось применение хирургического метода, который берет свое начало с 1962 г., когда N.Кау очистил от вегетаций трехстворчатый клапан. В 1963 г. D.Wallace произвел первое успешное протезирование аортального клапана в неактивную фазу заболевания, а в 1965 г. митральное протезирование у больного с активным инфекционным процессом. В дальнейшем хирургическое лечение получило широкое распространение во всем мире.
Этиология, патогенез, патологическая анатомия инфекционного и протезного эндокардита
Этиология инфекционного эндокардита значительно изменилась вследствие активного применения антибиотиков во всем мире. Раньше основной причиной заболевания были различные виды стрептококка и особенно Streptococcus viridans. В 1940 г. 95% случаев инфекционного эндокардита были вызваны данным видом инфекции. В настоящее время основная роль отводится стафилококкам и грамотрицательной флоре а также грибковой инфекции.
Отмечено влияние особенностей современной инфекции на течение болезни. Золотистый стафилококк отличается высокой вирулентностью, быстрым развитием тяжелых клапанных поражений, развитием метициллинустойчивых штаммов. Эпидермальный стафилококк отличается сродством к чужеродным тканям, имплантированным в организм человека, в том числе к механическим и биологическим протезам клапанов сердца; частым несоответствием чувствительности in vitro и чувствительности in vivo; быстрым развитием метицилинрезистентных штаммов; выработкой мукополисахаридов, снижающих эффективность антибиотиков и факторов защиты организма; минимальными клиническими проявлениями инфекции. Грамотрицательная флора характеризуется вариабельностью чувствительности и устойчивости. Грибковая инфекция имеет наиболее неблагоприятный прогноз. Стрептококковая инфекция, как правило, хорошо поддается медикаментозному лечению.
Ранний протезный эндокардит возникает в течение первых 2 месяцев после протезирования клапанов сердца. В большинстве случаев он вызывается эпидермальным стафилококком. Поздний протезный эндокардит развивается после 2 месяцев от момента клапанного протезирования, и основную этиологическую роль при этом играет стрептококковая инфекция.
Патогенез инфекционного эндокардита до сих пор не вполне ясен. Исследователи считают, что должны существовать следующие условия:
а) бактериемия,
б) травматизация эндокарда,
в) адгезия микроорганизмов на пораженном эндокарде,
г) развитие микробных вегетаций.
C транзиторными бактериями человек сталкивается постоянно. Например, простая чистка зубов в 26% сопровождается бактериемией. Деструктивные изменения в эндокарде наблюдаются при травматизации его струей регургитации или турбулентными потоками при пороках и аномалиях развития сердца, после травм и операций. Наибольший риск развития инфекционного эндокардита наблюдается у лиц с искусственными протезами клапанов сердца, аортальными пороками, митральной регургитацией, с открытым артериальным протоком, дефектом межжелудочковой перегородки, коарктацией аорты. Возможно, при данной патологии формируются наилучшие условия для адгезии микроорганизмов и развития вегетаций благодаря эффекту Вентури и стригущему эффекту.
В то же время Durack D.T (1981) считает, что в острых случаях чаще поражаются нормальные клапаны. Некоторые микроорганизмы (Staphylococcus aureus, Streptococcum pneumonia, Haemophilus influenza) могут непосредственно фиксироваться на эндотелии. Stulz P. (1988) отметил, что более чем у 50% больных инфекционный эндокардит развился на интактном клапане. Предрасполагающими факторами являются физические и психические перегрузки и снижение иммунитета. Следует отметить, что наиболее высок риск развития протезного эндокардита в первые 6 недель после операции. Он связан с бактериемией во время и в последующие несколько суток после оперативного вмешательства. Если протезирование клапанов осуществлялось по поводу активного инфекционного эндокардита, то риск возникновения протезного эндокардита увеличивается в 510 раз.
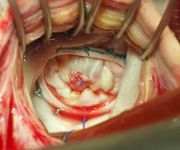
C точки зрения хирургии сердца в патогенезе инфекционного эндокардита наибольшее значение имеет факт быстрого разрушения клапанного аппарата сердца. 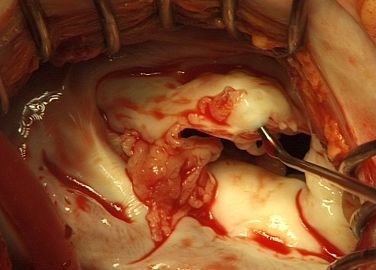
Активный эндокардит митрального клапана
Это приводит к катастрофическому нарастанию сердечной недостаточности, так как миокард не успевает приспособиться к резкому нарушению гемодинамики. Отягощающими обстоятельствами являются: появление антимиокардиальных и антиэндокардиальных антител, поражение проводящей системы сердца, изменение иммунореактивности организма.
К характерным патологоанатомическим признакам инфекционного эндокардита относятся: вегетации, разрывы хорд и папиллярных мышц, разрывы, отрывы и фенестрации створок, абсцессы, микотические аневризмы, дефекты перегородок, обтурации инфицированными тромбами. При протезном эндокардите вегетации встречаются в 70-90%, абсцессы фиброзного кольца и парапротезные фистулы в 70% случаев. Протезный эндокардит чаще развивается после многоклапанного протезирования, как правило, наблюдается поражение одного из искусственных клапанов сердца, отмечается большая частота эндокардита аортального протеза.
Хирургическая классификация клапанных поражений выделяет инфекционное поражение:
а) ограниченное створками клапанов,
б) распространяющееся за пределы фиброзного кольца
Особенности клиники и диагностики инфекционного и протезного эндокардита
Клинические проявления инфекционного эндокардита можно разделить на 3 группы: инфекция, сердечные поражения и поражение других органов. Эти проявления за последние пять десятилетий претерпели значительные изменения. Pelletier L., Petersdorf R. (1985) привели частоту различных симптомов у больных с инфекционным эндокардитом.
| Симптомы | Частота (%) |
|---|---|
| Лихорадка | 84 |
| Озноб | 41 |
| Слабость | 38 |
| Одышка | 36 |
| Потливость | 24 |
| Потеря веса | 24 |
| Кашель | 24 |
| Эмболии мозга | 18 |
| Рвота | 17 |
| Боль в грудной клетке | 16 |
| Сердечные шумы | 89 |
| Кожные проявления | 50 |
| Спленомегалия | 28 |
| Септические осложнения | 19 |
| Микотические аневризмы | 18 |
| Гломерулонефрит | 15 |
| Барабанные палочки | 12 |
| Поражение сетчатки | 9 |
Таким образом, среди важнейших признаков болезни лихорадка может отсутствовать у 15-16% пациентов, сердечные шумы у 10-15%, частота кожных проявлений сократилась с 85% в доантибиотическую эру до 20-40% в наше время, соответственно частота развития спленомегалии с 80-90% до 20-30%. Клинические проявления при благоприятном и неблагопрятном течении первичного инфекционного эндокардита на фоне медикаментозного лечения представлены в таблице.
| Клинические признаки | Неблагоприятное течение (%) | Благоприятное течение (%) |
|---|---|---|
| Длительная лихорадка | 53, 7 | 38,8 |
| Поражение аортального клапана | 34 | 56,2 |
| Поражение аортального клапана в сочетании с митральным | 17 | 8,7 |
| Сердечная недостаточность | 58,3 | 6,3 |
| Спленомегалия | 68,3 | 46,2 |
| Миокардит | 36,6 | 12,5 |
| Гломерулонефрит | 92,7 | 58,8 |
| Почечная недостаточность | 29,3 | 2,5 |
| Геморагический васкулит | 63,4 | 31,6 |
| Рецидивирующие тромбоэмболии | 43,6 | 6,3 |
| Анемия | 78 | 46,3 |
| Лимфопения | 70,7 | 42,5 |
| СОЭ ( > 50 мм\час.) | 53,7 | 31,2 |
| Гемокультура стафилококков | 57,1 | 16,7 |
| Гемокультура стрептококков | 28,6 | 8,1 |
| Наличие крупных вегетаций | 36 | 8,7 |
| Деструкция клапанов | 48 | 2,9 |
Такие клинические признаки, как длительная лихорадка, геморагический васкулит, деструктивные изменения клапанов ассоциируются с неблагоприятным прогнозом и требуют активного лечения - протезирования клапанов сердца.
Для установления диагноза инфекционного эндокардита предложены основные критерии заболевания (лихорадка с ознобами, кожные проявления, появление или изменение шумов в области сердца, тромбоэмболии, спленомегалия, положительные гемокультуры, положительный эффект антибиотикотерапии) и дополнительные критерии (геморагии, исхудание, артрит и артралгии, анемия, высокое СОЭ).
При протезном эндокардите клиника имеет много схожего. Общеприняты следующие диагностические критерии протезного эндокардита:
• наличие двух и более клинических признаков: лихорадка, петехии, изменившийся или новый шум над сердцем, наличие вегетаций, эмболии, спленомегалия, воспалительные изменения крови, анемия;
• наличие гистопатологических признаков эндокардита.
Диагноз выставляется при наличии двух из вышеуказанных критериев.
При инфекционном эндокардите и протезном эндокардите бактериемия наблюдается всегда, поскольку микроорганизмы постоянно попадают в кровоток с поверхности пораженных клапанов и вегетаций, поэтому положительные посевы должны наблюдаться в 85-98% случаев. Причинами отрицательных посевов являются: неинфекционный эндокардит, предшествующая антибиотикотерапия, Q-лихорадка, грибковая, хламидийная инфекция, acid-fast бактерии, L-формы бактерий, вирусная инфекция, эндокардит правых отделов сердца, уремия. Отмечено, что бактериемия при инфекционном эндокардите качественно постоянна, но количественна различна. Венозная кровь содержит бактерии лишь в 35% случаев. Поэтому многие авторы рекомендуют проводить забор крови на гемокультуру:
а) из артерии;
б) на высоте лихорадки или после физической нагрузки;
в) многократно;
г) на протяжении длительного времени (до недели).
Объем однократного забора не должен быть меньше 10 мл. Следует также использовать различные виды сред. Иногда идентифицировать микроорганизм можно с помощью спинномозговой пункции.
Дифференциальная диагностика раннего протезного эндокардита в короткие сроки после операции трудна. Это обусловлено тем, что причины послеоперационной лихорадки могут быть различны: постперфузионный синдром, постперикардиотомный синдром, обострение ревматического процесса, дисбактериоз, инфекция раны грудины, пневмония, флебит, инфекция мочевыносящих путей. Некоторые авторы указывают, что даже положительные посевы крови в период до 25 дней после операции не свидетельствуют о том, что источником бактериемии является искусственный клапан.
ЭхоКГ является важнейшим методом диагностики инфекционного эндокардита и протезного эндокардита, прогноза заболевания и тактики лечения. Впервые вегетации клапанов сердца при эндокардите были описаны с помощью ЭхоКГ в 1973 г. В дальнейшем особенности исследования были связаны с техническим совершенствованием метода: развитием двухмерной ЭхоКГ, внедрением допплеровского исследования, применением транспищеводной эхокардиографии. Двухмерная ЭхоКГ позволяет установить диагноз инфекционного эндокардита в 50-80% случаев. Недостатки метода связаны с невозможностью рассмотреть мелкие (менее 3 мм) вегетации. Возможны отрицательные результаты при наличии дисфункции протезов клапанов сердца и в то же время нередко наблюдаются ложноположительные результаты. Транспищеводная ЭхоКГ является более информативной (90-95%) в диагностике инфекционного эндокардита и протезного эндокардита. Интерпретацию данных эхокардиографического исследования следует проводить в сочетании с клиническими проявлениями и результатами микробиологического исследования.
Иммунологические методы у больных с инфекционным и протезным эндокардитом необходимы для определения стадии процесса, динамики послеоперационного течения. В активной стадии заболевания наблюдаются значительные сдвиги в иммунной системе. Наблюдается угнетение Т-системы лимфоцитов по реакциям Е-РОК и Еа-РОК, увеличение титра иммуноглобулинов G и М, отмечается высокий уровень циркулирующих иммунных комплексов, снижение уровня комплемента. У 50% пациентов может быть выявлен положительный ревматоидный фактор. Определяются перекрестно реагирующие антисарколемальные антитела, которые могут играть определенную роль в возникновении миокардиальной сердечной недостаточности. При успешном хирургическом лечении происходит резкое снижение уровня циркулирующих иммунных комплексов, уже в первые недели имеется тенденция к нормализации Т-системы. Показатели гуморального иммунитета изменяются более медленно.
Отношение ряда авторов к методу ангиокардиографии неоднозначно. С помощью этого метода можно определить наличие абсцессов и фистул, оценить прочность фиксации протеза к клапанному кольцу при протезном эндокардите, обнаружить необычные и клинически нераспознанные внутрисердечные осложнения, определить протяженность и гемодинамическую значимость анатомических поражений, выявить инфицированные клапаны. Тем не менее, применение сердечной катетеризации при инфекционном эндокардите сопряжено с риском эмболизации и гемодинамической нестабильности, часто наблюдаются смертельные исходы. Поэтому при ясной клинике и положительных эхокардиографических данных проведение ангиографии нецелесообразно. Исключение составляют случаи выявления поражения коронарных артерий и диагностики абсцесса кольца клапана.
Описываются и другие методы диагностики, такие, как компьютерная и ЯМР-томография, сцинтиграфия, но они не получили широкого применения вследствие дороговизны исследований и отсутствия диагностических преимуществ.
Классификация инфекционного и протезного эндокардита
Классификация инфекционного эндокардита за годы исследования и формирования учения об этом заболевании претерпела множество изменений. В зарубежной литературе отмечается, что термины острый, подострый и хронический эндокардит возникли в доантибиотическую эру и являются некорректными. В современных условиях в кардиохирургической практике выделяют инфекционный эндокардит «активный» и «неактивный» или «заживленный».
В различных хирургических центрах применяют следующие критерии активности процесса при инфекционном эндокардите:
- два и более клинических проявления болезни;
- две и более положительных гемокультуры с одним и тем же микроорганизмом;
- признаки активной инфекции во время операции;
- гистопатологическое подтверждение активности процесса.
Основным доказательством активного инфекционного эндокардита является воспалительный процесс на клапанах. Применяемая в настоящее время отечественная хирургическая классификация инфекционного эндокардита разработана в ИССХ им. Бакулева, представленная на рисунке.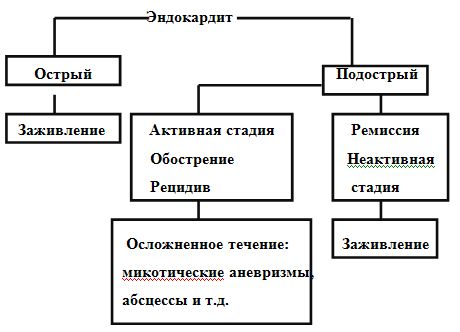
Классификация инфекционного эндокардита
Протезный эндокардит подразделяется на ранний протезный (возникает в течение 60 дней после протезирования клапанов сердца) и поздний (развивается после 60 дней от протезирования клапанов сердца) эндокардит.
Показания к хирургическому лечению у больных с инфекционным и протезным эндокардитом
Более просто решается вопрос о необходимости операции в стадии ремиссии. Операция производится в плановом порядке при наличии недостаточности кровообращения NYHA III–IV, или NYHA II, если имеет место гемодинамически значимый порок.
До недавнего времени активный инфекционный эндокардит был прямым противопоказанием к вмешательствам на сердце. Считалось, что такие операции противоречат принципам асептики в хирургии. Единственными методами хирургического лечения были удаление инфицированной селезенки, периферических микотических аневризм, перевязка инфицированного открытого артериального протока. Считалось, что необходимо лечить пациентов консервативно до стихания инфекционного процесса и производить операцию в стадии ремиссии. Ряд исследователей указывали, что основной задачей является достижение ремиссии септического процесса до операции. В то же время длительная и неэффективная медикаментозная терапия может привести к необратимым изменениям миокарда и значительно ухудшить результаты необходимой в последующем операции.
Поэтому, несмотря на то, что адекватная антибиотикотерапия является основой в лечении активного инфекционного эндокардита, нужна постоянная настороженность в отношении необходимости хирургического подхода. Устанавливается постоянный мониторинг для выявления:
1) изменений гемодинамического статуса;
2) персистенции и распространенности инфекции;
3) развития метастатических очагов инфекции;
4) системных эмболий.
Необходимо проведение посевов крови на протяжении всей терапии, регулярный мониторинг ЭКГ и ЭхоКГ. Решение о необходимости хирургического лечения возникает, как правило, при развитии "осложненного инфекционного эндокардита", когда оперативное лечение оказывается более успешным, чем терапевтический подход.
Хирургическое лечение показано: при развитии сердечной недостаточности; персистирующей бактериемии, несмотря на адекватную антибиотикотерапию; повторных эмболиях; грибковых эндокардитах. Однако многие эксперты считают, что для решения вопроса об оперативном лечении нужен индивидуальный подход с учетом многих факторов. В этой связи James W.Breaks (1988) с соавторами предложил пользоваться абсолютными и потенциальными показаниями к операции.
| Наименование | Абсолютные | Потенциальные |
|---|---|---|
| Гемодинамический фактор | Тяжелая или прогрессирующая | Легкая и средняя сердечная недостаточность |
| Эмболические осложнения | Множественные эмболии | Единичные эмболии Вегетации при ЭхоКГ |
| Признаки инфекции | Персистирующая бактериемия, несмотря на антибиотикотерапию Грибковый эндокардит |
Лихорадка при отрицательных посевах на фоне антибиотикотерапии Абсцессы: перианулярные, миокарда, аневризмы синуса Вальсальвы Новые или усиливающиеся повреждения проводящей системы Инфекция, иная, чем стрептококковая Реинфекция |
Наличие одного абсолютного или двух и более потенциальных признаков является показанием к оперативному лечению.
Прогноз при развитии средней и тяжелой степени сердечной недостаточности при консервативной терапии неблагоприятен. Госпитальная летальность в этом случае составляет 66%, а при поражении аортального клапана - 80%. Поэтому особенно важна более активная хирургическая тактика, когда речь идет о поражении аортального клапана. Необходимо учитывать и тот факт, что инфекция на аортальном клапане более рефрактерна к антибиотикотерапии. Вовремя произведенная операция протезирования аортального клапана может предупредить распространение инфекции на корень аорты.
Поскольку оперативная летальность увеличивается в зависимости от степени сердечной недостаточности, учет определенных факторов может облегчить принятие решения об операции еще при благоприятной гемодинамике. Так, возникновение аортальной недостаточности более опасно, чем митральной. Увеличение регургитации на аортальном клапане по данным ЭхоКГ, даже при умеренной сердечной недостаточности является показанием к срочной операции. Напротив, митральная недостаточность может успешно корригироваться медикаментозно.
Вторым важным фактором является вид инфекции. Например, грибковый эндокардит при консервативном подходе имеет фатальный прогноз в 100% случаев. При хирургическом лечении удалось снизить летальность до 50%. Все микроорганизмы, за исключением пенициллин-чувствительных стрептококков, ассоциируются с высоким риском при медикаментозном лечении. Особенно опасны грамотрицательная флора и золотистый стафилококк. Одни авторы рекомендуют в этих случаях раннюю операцию, другие отдают предпочтение консервативному методу и только при угрозе осложнений склоняются к хирургическому подходу.
Множественные эмболии - показание для ранней операции. Так, эмболия коронарных артерий ассоциируется с летальностью более 70%, эмболия мозговых сосудов 30-50%. При одиночной эмболии пациент ведется по индивидуальному графику, так как одиночная эмболия во многих случаях предшествует множественной. Вегетации, выявленные на ЭхоКГ, предшествуют эмболическим осложнениям. Требуют активной хирургической тактики подвижные вегетации более 1 см в диаметре.
Оперативное лечение необходимо при рецидиве инфекции, разрывах папиллярных мышц и хорд, признаках внутрисердечного распространения инфекции, в случае образования внутрисердечных абсцессов и фистул, при нарастающих явлениях почечной недостаточности и иммунокомплексной патологии, а также во всех случаях протезного эндокардита.
Сроки хирургического лечения при активном инфекционном эндокардите точно не определены. Отечественные публикации указывают, что средняя продолжительность дооперационного лечения составляла 6-14 месяцев. Однако, ряд авторов рекомендуют производить операцию в сроки от 4-6 недель до 5-7 дней от начала неэффективной медикаментозной терапии. Показаны успешные результаты хирургического лечения больных с активным инфекционным эндокардитом на третий день от начала антибиотикотерапии. В целом отмечается необходимость более активной хирургической тактики при инфекционном эндокардите, так как госпитальная летальность снижается с 44-90 % при поздних, до 14-17 % при ранних сроках операций.
При развитии раннего протезного эндокардита многие авторы рекомендуют неотложное хирургическое лечение. При позднем протезном эндокардите в случае стрептококковой инфекции, отсутствии парапротезных фистул, застойной сердечной недостаточности, эмболических осложнений возможен вариант медикаментозной терапии, когда можно добиться излечения в 65%.
S.Gnann и H.Cobs (1987) предложили руководство к хирургическому лечению инфекционного эндокардита и протезного эндокардита, учитывая клиническую ценность отдельных признаков в баллах.
| Симптомы | Инфекционный эндокардит | Протезный эндокардит |
|---|---|---|
| Сердечная недостаточность: - тяжелая - умеренная - легкая |
5 3 1 |
5 5 2 |
| Грибковый эндокардит | 5 | 5 |
| Персистирующая бактериемия | 5 | 5 |
| Микроорганизмы иные, чем стрептококки | 1 | 2 |
| Рецидив | 2 | 3 |
| Одиночная эмболия | 2 | 2 |
| Две и более эмболии | 4 | 4 |
| Вегетации ( ЭхоКГ ) | 1 | 1 |
| Раннее закрытие митрального клапана (ЭхоКГ ) | 2 | - |
| Разрыв хорд и папилярных мышц | 3 | - |
| Атриовентрикулярная блокада | 3 | 3 |
| Разрывы синуса Вальсальвы и перегородок сердца | 4 | 4 |
| Ранний протезный эндокардит | - | 2 |
| Парапротезная фистула | 2 | 2 |
| Дисфункция протеза при протезном эндокардите | - | 5 |
При наличии 5 и более баллов необходима операция.
Хирургическое лечение инфекционного и протезного эндокардита
Главной проблемой хирургического лечения является предотвращение рецидива инфекции и развития протезного эндокардита. Основой для выбора тактики являются анатомические изменения, выявленные на операционном столе: степень поражения фиброзного кольца и окружающих тканей, а также наличие вегетаций, абсцессов, фистул, отрывов протезов.
Если фиброзное кольцо митрального или аортального клапанов незначительно повреждено инфекцией, то применяется простое протезирование клапанов. При наличии обширного абсцесса в области митрального кольца используется техника транслокации протеза, когда последний на дакроновой заплате подшивается за стенки левого предсердия. При распространении инфекции на фиброзное кольцо аортального клапана и нарушении непрерывности между аортой и левым желудочком применяются различные методики транслокации и фиксации протеза: путем проведения швов через стенку аорты, применением клапансодержащих кондуитов с субкоронарной или супракоронарной имлантацией протеза с реимплантацией коронарных артерий или АКШ. 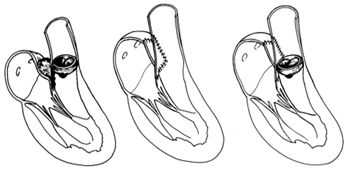
Восстановление корня аорты при абсцессе аортального кольца
Применяется также частичная транслокация аортального протеза с одиночным АКШ.
Широкое применение получило использование ксеноматериалов (ксеноперикард, ксенодиафрагма), аутоперикарда и дакрона для закрытия абсцессов, фистул сердца. 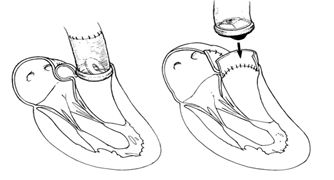
Восстановление выходного тракта левого желудочка при распространении инфекции
Если восстановление непрерывности между аортой и левым желудочком невозможно, применяется техника апикоаортального протезирования клапансодержащим кондуитом.
Распространение абсцесса на область митрально-аортального контакта и выходной тракт левого желудочка - наиболее сложный случай для реконструкции. В этой ситуации полностью резецируется вся инфицированная ткань с нативными клапанами или протезами.
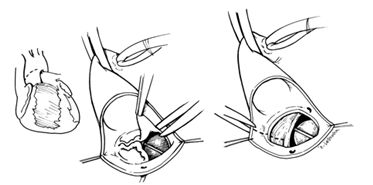
Удаление клапанов при распространении инфекции на область митрально-аортального контакта
Таким образом основа левого желудочка становится широко открытой без разделения между его приточным и выходным отделами.
Иссечение инфицированных клапанов
Реконструкция достигается с помощью использования двух треугольных заплат из ксенопрерикарда, восстанавливающих как купол левого предсердия, так и корень аорты.
Формирование из приточного и выходного отдела левого желудочка единого отверстия и восстановление их формы с помощью заплат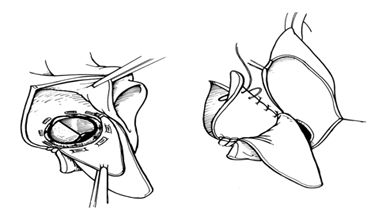
Имплантация митрального протеза и восстановление купола левого предсердия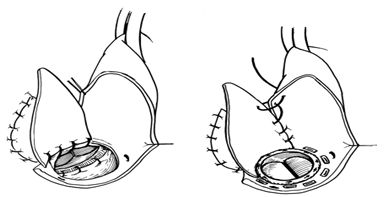
Имплантация аортального протеза и восстановление восходящей аорты
Выбор вида протеза при инфекционном эндокардите и протезном эндокардите дискутируется. Так, ряд авторов указывают, что механические протезы более предпочтительны при активном инфекционном эндокардите и протезном эндокардите, поскольку биопротезы имеют большую частоту развития инфекционных осложнений. Grover F.L. c cоавт. (1994) не выявил статистически значимых различий в частоте возникновения протезного эндокардита у больных с биологическими и механическими протезами. Wisman C.B.(1989) также считает, что все виды механических и биологических протезов имеют одинаковый риск развития инфекционных осложнений в условиях инфекционного эндокардита. Однако, в последнее время отдается предпочтение к применения биопротезов и аллографтов.
После протезирования клапанов в условиях активного эндокардита сохраняется высокая вероятность рецидива инфекции, развития фистул и, как следствие, рост госпитальной летальности. Применение аллографтов улучшило результаты при эндокардите аортального клапана, однако не всегда возможно подобрать аллографт соответствующего размера, особенно в экстренной ситуации, велико число пациентов с эндокардитом митрального клапана, и в большинстве случаев все же выполняется клапанное протезирование. Поэтому ведутся поиски путей предупреждения протезного эндокардит, рецидива и персистенции инфекции.
Многие авторы указывают на преимущества использования аллографтов при инфекционном эндокардите и протезном эндокардите аортального клапана. Наибольшую популярность получили криосохраненные аллографты, которые длительно не подвергаются дегенеративным изменениям, при этом значительно снижается риск рецидива инфекции.
При эндокардите трехстворчатого клапана проводятся клапансохраняющие операции (вегетэктомия, резекция пораженных участков клапанов с последующей пластикой ксеноперикардом) или биопротезирование. Ряд авторов указывают на высокий риск рецидива инфекции при протезировании трехстворчатого клапана, особенно у пациентов, продолжающих употреблять наркотики, и считают, что операцией выбора при эндокардите правых отделов сердца является удаление трехстворчатого клапана. При этом только 11% пациентов в дальнейшем требуют протезирование клапана вследствие рефрактерной к медикаментам сердечной недостаточности.
Как известно, особенно опасны для развития эндокардита протеза первые несколько недель после его имплантации. Полагают, что придание манжете протеза антибактериальных свойств на этот период может снизить частоту протезного эндокардита. Некоторые исследователи осуществляют импрегнацию манжеты рифампицином в растворе альбумина или плазмы крови, применяются антибиотико-высвобождающие носители (гентамицин-полиметилкрилат), фибринная отвердевающая композиция, содержащая большие концентрации 2-3 антибиотиков, фибриновый клей, включающий неомицин. Упоминается о применении протезов, манжеты которых импрегнировались серебром.
Особое значение в последние годы отводится реконструктивным операциям, особенно при поражении эндокардитом митрального или трехстворчатого клапанов, которые ранее считались абсолютно бесперспективными. Новый подход к таким операциям базируется на следующих агрессивных принципах:
а) время операции при остром процессе должно быть максимально сокращено - до 1 недели;
b) радикальное иссечение всех пораженных тканей;
с) зараженные ткани должны быть обработаны антисептиками или по возможности удалены. По мнению G.E.Khoury (2004) хирургический подход к лечению острого эндокардита должен быть подобен тактике лечения раковых заболеваний.
Вследствие радикального иссечение пораженных тканей возникает необходимость в замещении возникающих дефектов для восстановления нормальной функции митрального клапана. При этом возможны несколько вариантов:
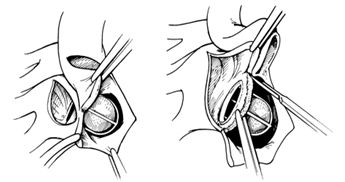
а) в случае небольших дефектов – пластика собственными тканями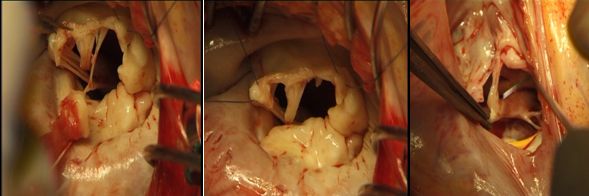
Реконструкция передней створки митрального клапана собственными тканями
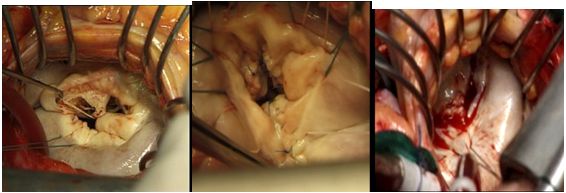
Радикальное удаление пораженных структур и восстановление функции митрального клапана
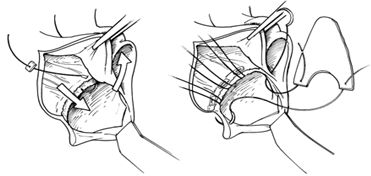
b) в случаях больших дефектов – использование ауто- или ксеноперикарда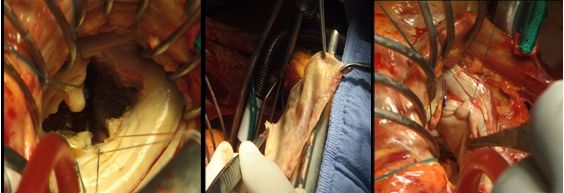
Использование ксеноперикарда при пластике задней створки митрального клапана
с) при необходимости резекции не только створок но и хорд – применение ауто- (задняя створка трехстворчатого клапана) и аллографтов
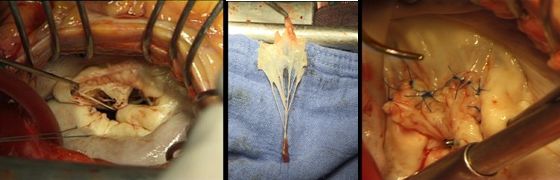
Использование задней створки трехстворчатого клапана при замещении дефекта передней створки митрального клапана
Обязательным этапом оперативного вмешательства по поводу инфекционного эндокардит и протезного эндокардита является санация камер сердца. Необходимость тщательной ревизии и удаление всех воспаленных тканей отмечается многочисленными авторами. Используется ультразвуковая кавитация полостей сердца, производится обработка пораженных структур сердца препаратами йода растворами хлоргексидина, диоксидина и другими антисептиками. Однако оптимальный антисептик не найден. Так, хлоргексидин способен вызвать тотальный гемолиз при его попадании в кровоток, чего трудно избежать в условиях работы на открытом сердце. В экспериментальных условиях показано, что препараты йода не подавляют инфекцию, которая распространяется вглубь тканей сердца.
Принципы искусственного кровообращения и защиты миокарда у больных с инфекционным эндокардитом и протезным эндокардитом освещены в литературе в меньшей степени, чем хирургические методики. Отмечается, что у таких больных имеются значительные нарушения в системе гомеостаза, изменена реактивность организма. Это проявляется высокой концентрацией факторов цитокинеза, повреждениями в системе коагуляции и неспецифического протеолиза вследствие активации различных каскадных систем плазмы крови. Провоцирующая роль ИК заключается в том, что при соприкосновении крови с чужеродной поверхностью происходит активация комплемента, который в свою очередь индуцирует серию воспалительных реакций, включающих высвобождение гистамина, протеолитических ферментов, цитокинетиков, дериватов арахидоновой кислоты.
Клиническим воплощением этих изменений во время ИК является стойкая вазоплегия, после операции высок риск гипокоагуляционных кровотечений, повышена вероятность гемолиза крови и почечной недостаточности. Поэтому у таких больных мы используем большие дозы ингибиторов протеолитических ферментов в сочетании с глюкокортикостероидами, добиваемся гемодилюции с показателем гематокрита крови 22-25 %, для предоперационной подготовки применяем реологические препараты, плазмоферез, стабилизаторы тучных клеток, иммуномодуляторы. Для борьбы с инфекцией в аппарат ИК вводятся суточные дозы 1-2 антибиотиков.
Результаты хирургического лечения инфекционного и протезного эндокардита
Госпитальная летальность после операций по поводу инфекционного эндокардита и протезного эндокардита варьирует в широких пределах. Летальность у больных с инфекционным эндокардитом в активной стадии заболевания составляет 4-50%, при раннем протезном эндокардите - 20-80%, позднем - 12-60%, при инфекционным эндокардитом в стадии ремиссии 2-8,7%. Отдаленные результаты благоприятны у 60-90 % больных. Рецидив инфекции наблюдался в 3,5 % - 33,3 %.
Зависимость результатов хирургического лечения инфекционным эндокардитом и протезным эндокардитом от различных факторов широко обсуждается в литературе. Среди причин, ухудшающих показатели выживаемости больных, называют следующие: выраженная сердечная недостаточность, длительные сроки дооперационного лечения, длительное время операции, искусственного кровообращения и ишемии миокарда, поражение аортального клапана, инфекция, выходящая за пределы створок клапанов, стафилококковая, грамотрицательная, грибковая инфекция, ранний протезный эндокардит, периферические эмболии, почечная недостаточность, эндокардит, развившийся на фоне ревматических пороков сердца, возраст старше 50 лет, операция по экстренным показаниям, опыт хирурга и др.
С 2000 по 2004 годы в Беларуси оперированы 114 пациентов с инфекционным эндокардитом в активной стадии, 18 больных с протезным эндокардитом и 61 пациент с инфекционным эндокардитом в стадии ремиссии. К III и IV функциональным классам по классификации NYHA относились 93% пациентов. Средний возраст больных составил 38±10 лет, 70 % оперированных были лицами мужского пола.
Положительная гемокультура у пациентов с активной фазой инфекционным эндокардитом и протезным эндокардитом получена только в 24% случаев. Микробный спектр представлен различными видами стафилококков – 54%, стрептококков –21%, грамотрицательной – 21%, кандидами- 4%.
При исследовании чувствительности и устойчивости флора, представленная эпидермальным, золотистым стафилококком и грамотрицательными бактериями, имела множественную резистентность к основным видам антибиотиков. Так, при исследовании коэффициента корреляции обнаружена достоверная тесная связь (r = 0,75 при p<0,001) между антибиотикоустойчивостью и сроками дооперационного лечения больных с активным инфекционным эндокардитом.
Оперативные вмешательства заключались в замене пораженных клапанов, и только у 8,4% больных проведена пластическая коррекция. В большинстве случаев использовались м искусственные клапаны сердца ПЛАНИКС и биопротезы с эпоксидной обработкой. Многоклапанные коррекции проведены у 28% пациентов, сочетанные операции АКШ - у 3,4% больных, различные виды пластики корня аорты - в 3,4% случаях.
Антибиотикотерапия у больных с активным инфекционным эндокардитом и протезным эндокардитом проводилась с момента поступления больных в стационар, продолжалась во время операции и на протяжении всего госпитального периода. Для улучшения результатов в клинике стала применяться методика внутрисердечного введения антибиотиков через микроирригатор в течении 48 часов после операции. Внутриоперационная санация инфекции проводилась путем тщательного удаления инфицированного эндокарда, обработки пораженных тканей антисептиками: иодонатом, первомуром. В последнее время для этих целей используется 30% раствор димексида.
Госпитальная летальность составила 6,2%. Среди больных с неактивным инфекционным эндокардитом госпитальной летальности не было, в то время как у больных с активным инфекционным эндокардитом и протезным эндокардитом послеоперационная летальность составила 9,1 %. Это соответствует данным многих авторов и подтверждает факт, что хирургическое лечение активной инфекции клапанов сердца является нелегкой задачей.
Причинами госпитальной летальности явились: сердечная недостаточность - 33,3%, рецидив инфекции - 33,3%, отек головного мозга - 16,7%, кровотечение - 8,3%, тромбоэмболия сосудов головного мозга - 8,3%. В группе больных, которым обработка камер сердца во время операции проводилась раствором димексида и осуществлялось внутрисердечное введение антибиотиков в раннем послеоперационном периоде, рецидив инфекции наблюдался у 4,3 % больных. У пациентов, которым проводилась обычная антибиотикотерапия, а в качестве интраоперационного антисептика применялся йодонат рецидив эндокардита развился у 8,9%. Актуарная выживаемость за трехлетний период наблюдения у пациентов с инфекционным эндокардитом и протезным эндокардитом составила 89,4 %.
Актуарная выживаемость пациентов с инфекционным эндокардитом и протезным эндокардитом за трехлетний период наблюдения (без учета госпитальной летальности)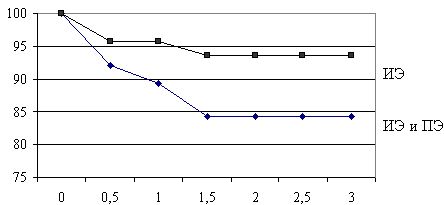
Актуарная выживаемость пациентов с инфекционным эндокардитом (ИЭ) и протезным эндокардитом (ПЭ) за трехлетний период наблюдения (без учета госпитальной летальности)
В отдаленном периоде 70 % пациентов принадлежали к I функциональному классу NYHA, при этом у больных, оперированных в острой стадии процесса, отмечена более значительная положительная динамика. Это подтверждает успешность метода хирургической коррекции нарушений гемодинамики у пациентов с инфекционным эндокардитом и протезным эндокардитом.
Лечение инфекционного эндокардита в Беларуси - европейское качество за разумную цену
Профессор, доктор медицинских наук Ю.П. Островский



