Рабочая группа по диагностике и лечению легочной артериальной гипертензии Европейского общества кардиологов
Guidelines on diagnosis and treatment of pulmonary arterial hypertension
The Task Force on Diagnosis and Treatment of Pulmonary Arterial Hypertension of the European Society of Cardiology
Содержание:
3. Определение легочной артериальной гипертензии
4. Клиническая классификация легочной гипертензии
5. Факторы риска и состояния, связанные с легочной артериальной гипертензией
6. Классификация врожденных системно-легочных шунтов
7. Патоморфология легочной артериальной гипертензии
8. Патогенез легочной артериальной гипертензии
Диагностика легочной гипертензии:
9. Клиническое подозрение о легочной гипертензии
13. Оценка тяжести легочной гипертензии
Лечение:
Особые состояния
Список сокращений
6МТ - тест с 6-минутной ходьбой
АЛАГ - ассоциированная легочная артериальная гипертензия
АНА - антинуклеарные антитела
АЭР - антагонисты эндотелиновых рецепторов
БАЛ - бронхо-альвеолярный лаваж
ВИЧ - вирус иммунодефицита человека
ВОЗ - Всемирная организация здравоохранения
ДЛА - давление в легочной артерии
ДМПП - дефект межпредсердной перегородки
ДМЖП - дефект межжелудочковой перегородки
ДПП - давление в правом предсердии
Д-ЭхоКГ - допплер-эхокардиография
ЗСТ - заболевания соединительной ткани
ИЛАГ - идиопатическая легочная артериальная гипертензия
ИЗЛ - интерстициальное заболевание легких
КТ - компьютерная томография
КПНТ - кардиопульмональное нагрузочное тестирование
КТВР - компьютерная томография высокого разрешения
ЛАГ - легочная артериальная гипертензия
ЛВОБ - легочная вено-окклюзивная болезнь
ЛГ - легочная гипертензия
ЛДЗ - давление заклинивания в легочных капиллярах
ЛКГ - легочный капиллярный гемангиоматоз
ЛСС - легочное сосудистое сопротивление
ОФВ1 - объем форсированного выдоха за 1-ю секунду
ПЛГ - первичная легочная гипертензия
ПЛГН - персистирующая легочная гипертензия новорожденных
РКИ - рандомизированное клиническое исследование
сДЛА - систолическое давление в легочной артерии
сДПЖ - систолическое давление в правом желудочке
СЛАГ - семейная легочная артериальная гипертензия
ФДЭ-5 - ингибиторы фосфодиэстеразы 5-го типа
ХОБЛ - хроническая обструктивная болезнь легких
ХТЭЛГ - хроническая тромбоэмболическая легочная гипертензия
ЧП-ЭхоКГ - чреспищеводная эхокардиография
ЧСС - частота сердечных сокращений
ЭхоКГ - эхокардиография
BMPR2 - рецепторный костный морфогенетический протеина-2
DLco - диффузионная способность легких по монооксиду углерода
ESC - Европейское общество кардиологов
NYHA - Нью-Йоркская классификация Ассоциации сердца
РаСО2 - напряжение углекислого газа в артериальной крови
РаО2 - напряжение кислорода в артериальной крови
V / Q - вентиляционно-перфузионный
Легочная артериальная гипертензия
Легочная артериальная гипертензия (ЛАГ) определяется как группа заболеваний, характеризующихся прогрессивным повышением легочного сосудистого сопротивления (ЛСС), что ведет к правожелудочковой недостаточности и преждевременной смерти Средняя продолжительность жизни в середине 80-х гг. прошлого века от момента установления диагноза у больных с идиопатической ЛАГ (ИЛАГ), ранее известной как первичная легочная гипертензия (ПЛГ), до появления специфической направленной терапии была 2,8 лет.
ЛАГ включает
- ИЛАГ и
- легочную гипертензию (ЛГ) при различных других состояниях, таких как
- заболевания соединительной ткани (ЗСТ),
- врожденные шунты между системными и легочными сосудами,
- портальная гипертензия и
- ВИЧ-инфекция
При всех этих состояниях развиваются одинаковые обструктивные изменения в системе легочной микроциркуляции, что предполагает равнозначные патобиологические процессы при всех заболеваниях, сопровождаемых ЛАГ В последнее десятилетие достигнуты большие успехи в изучении патогенеза, в диагностике и лечении ЛАГ. Большим достижением в выяснении последовательности патогенетических событий при ЛАГ стало обнаружение мутаций рецепторного костного морфогенетического протеина 2 (BMPR2) в большинстве случаев семейной ЛАГ (СЛАГ).
Описаны разнообразные клеточные изменения в легочных сосудах больных, которые могут играть важную роль в развитии и прогрессировании ЛАГ. К ним относятся легочная эндотелиальная дисфункция, характеризующаяся нарушением синтеза оксида азота, тромбоксана А2, простациклина и эндотелина, патологией калиевых каналов и нарушением транспорта серотонина в гладкомышечных клетках, а также усилением продукции матрикса в адвентиции.
В настоящее время разработаны новая клиническая классификация и консенсус, основанные на алгоритмах различных диагностических мероприятий, которые позволяют исключить другие причины и обеспечивают точный диагноз ЛАГ. Кроме того, предложены неинвазивные маркеры тяжести заболевания, биомаркеры или физиологические тесты, которые могут широко применяться и позволяют надежно мониторировать клиническое течение болезни. Наконец, многочисленные контролируемые клинические исследования по ЛАГ, проведенные в последнее время, позволили отказаться от терапии, базирующейся на клинической картине, и принять стратегию, основанную на доказательствах, которая включает новые классы лекарственных препаратов, такие как
- простаноиды,
- антагонисты эндотелиновых рецепторов (АЭР) и
- ингибиторы фосфодиэстеразы 5-го типа (ФДЭ-5)
Настоящее руководство содержит четкие показания к практическому применению новой клинической классификации, краткий вариант новой патогенетической классификации и новый взгляд на патогенез этого заболевания. При обсуждении диагностического процесса построена логическая последовательность мероприятий для выявления этиологической причины, оценки тяжести и дальнейшего наблюдения за больным. Особое внимание обращается на алгоритм лечения, основанный на доказательствах, в соответствии с предложениями ESC по уровням доказательности и классам рекомендаций для доступных методов лечения.
Легочная гипертензия определяется как среднее артериальное давление в легочной артерии (среднее ДЛА) > 25 мм рт. ст. в покое или > 30 мм рт. ст. при физической нагрузке
Существующая классификация ЛГ представлена в табл. 1. Она представляет собой результат широкой дискуссии и консенсус, суммирующий наше современное понимание патофизиологии, а также клинические различия и сходства разных вариантов ЛГ. Пониманию и правильному клиническому применению классификации помогут следующие рассуждения.
Ранее легочная гипертензия разделялась на 2 категории: ПЛГ и вторичная ЛГ в зависимости от наличия или отсутствия выявленной причины или факторов риска. Диагноз ПЛГ был диагнозом исключения после исключения всех других причин ЛГ.
В 1998 г. во время II Всемирного Совещания по ЛГ, проходившего в г. Эвиане (Франция), была предложена классификация ЛГ, основанная на клинических проявлениях. Цель "Эвианской классификации" заключалась в выделении вариантов ЛГ, имеющих сходные патофизиологические механизмы, клинические проявления и лечебные подходы. Такая клиническая классификация необходима для обсуждения конкретных больных, стандартизации диагноза и лечения, проведении исследований на гомогенных группах больных и, наконец, для анализа патобиологических изменений в хорошо подобранных популяциях больных. Очевидно, что клиническая классификация не исключает существования других классификаций, таких как патологическая классификация, основанная на гистологических признаках, или функциональная классификация, основанная на тяжести симптомов.
III Всемирный симпозиум по легочной артериальной гипертензии, проведенный в 2003 г. в г. Венеции (Италия), оценил значение и целесообразность использования "Эвианской классификации" и предложил некоторые изменения. Было решено сохранить основную идею и структуру "Эвианской классификации", но в то же время был предложен ряд изменений, основными из которых явились отказ от термина "первичная легочная гипертензия" и замена его термином "идиопатическая легочная артериальная гипертензия", пересмотр места легочной вено-окклюзивной болезни (ЛВОБ) и легочного капиллярного гемангиоматоза (ЛКГ) в классификации, пересмотр факторов риска и состояний, связанных с ЛАГ, а также усовершенствование классификации врожденных системно-легочных шунтов (см. табл. 1).
Таблица 1. Клиническая классификация легочной гипертензии – г. Венеция, 2003 г.
1. Легочная артериальная гипертензия (ЛАГ)
1.1. Идиопатическая (ИЛАГ)
1.2. Семейная (СЛАГ)
1.3. Ассоциированная (АЛАГ) – связанная с:
1.3.1. заболеваниями соединительной ткани
1.3.2. врожденными шунтами между системными и легочными сосудами
1.3.3. портальной гипертензией
1.3.4. ВИЧ-инфекцией
1.3.5. лекарствами и токсинами
1.3.6. другими состояниями (патология щитовидной железы, заболевания, связанные с нарушением обмена гликогена, болезнь Гоше, наследственная геморрагическая телеангиоэктазия, гемоглобинопатии, миелопролиферативные заболевания, спленэктомия)
1.4. Связанная со значительными изменениями вен или капилляров:
1.4.1. легочная вено-окклюзивная болезнь (ЛВОБ)
1.4.2. легочный капиллярный гемангиоматоз (ЛКГ)
1.5. персистирующая легочная гипертензия новорожденных (ПЛГН)
2. Легочная гипертензия, связанная с патологией левого желудочка
2.1. Заболевания левого предсердия или левого желудочка
2.2. Патология клапанного аппарата левых отделов сердца
3. Легочная гипертензия, связанная с легочной респираторной патологией и / или гипоксией
3.1. Хроническая обструктивная болезнь легких
3.2. Интерстициальные заболевания легких
3.3. Нарушения дыхания во время сна
3.4. Альвеолярная гиповентиляция
3.5. Хроническое пребывание на больших высотах
3.6. Патология развития
4. Легочная гипертензия, обусловленная хроническим тромботическим и / или эмболическим заболеванием
4.1. Тромбоэмболическая обструкция проксимальных легочных артерий
4.2. Тромбоэмболическая обструкция дистальных легочных артерий
4.3. Нетромботическая легочная эмболия (опухолевая, паразитарная, инородным телом)
5. Смешанные причины
Саркоидоз, гистиоцитоз Х, лимфангиоматоз, сдавление легочных сосудов (лимфоаденопатия, опухоль, фиброзирующий медиастенит).
Целью этих изменений было сделать Венецианскую клиническую классификацию всеобъемлющей, более простой в использовании и распространить ее как практический инструмент.
Идиопатическая легочная артериальная гипертензия
Термин ПЛГ был принят "Эвианской клинической классификацией" из-за повсеместного его применения и привычности, а также из-за того, что в последние 50 лет он широко использовался в научных и клинических исследованиях. Однако слово "первичная" подразумевает использование термина "вторичная", от которого Эвианская версия отказалась из-за того, что он объединял очень разнообразную группу патологий. Во избежание любых недоразумений в г. Венеции было решено, что 1-я категория, называемая "первичной легочной гипертензией - ПЛГ", должна включать следующие 3 группы: идиопатическая легочная артериальная гипертензия – ИЛАГ, семейная легочная артериальная гипертензия – СЛАГ, легочная артериальная гипертензия, связанная с факторами риска или другими состояниями (ассоциированная легочная артериальная гипертензия – АЛАГ).
Фактором риска для ЛАГ является любой фактор или состояние, потенциально предрасполагающий или способствующий развитию заболевания. Факторы риска включают лекарства и химические вещества, заболевания и фенотипы (возраст, пол). Термин "состояния, связанные с ЛАГ" используется, если выявляется статистически достоверное возрастание частоты ЛАГ при влиянии данного предрасполагающего фактора, но при отсутствии "постулата Коха" для случайных взаимосвязей. Поскольку абсолютный риск известных факторов риска для ЛАГ в целом низкий, вероятно, важную роль играют индивидуальная восприимчивость или генетическая предрасположенность.
Во время Эвианского совещания в 1998 г. различные факторы риска и состояния, связанные с ЛАГ, были классифицированы соответственно силе их взаимосвязи с ЛАГ и их вероятной причинной роли.
"Определенными" были названы взаимосвязи, выявленные в нескольких однонаправленных наблюдениях, включая крупное контролируемое или эпидемиологическое исследование с однозначным результатом.
"Очень вероятные" взаимосвязи означали результаты нескольких однонаправленных исследований (в том числе крупных серий наблюдений и исследований), но в которых причина заболевания не была установлена.
"Вероятными" считались взаимосвязи, выявленные в сериях случаев, регистрах или на основании мнений экспертов.
"Маловероятными" назывались предполагаемые факторы риска, связь которых с ЛАГ не была установлена в контролируемых исследованиях.
В табл. 2 в соответствии с уровнем доказательности суммированы факторы риска и состояния, связанные с ЛАГ, известные ранее, а также и новые, которые установлены недавно в нескольких сериях наблюдений или в отдельных описанных случаях.
Таблица 2. Факторы риска и состояния, связанные с ЛАГ в зависимости от уровня доказательности
1. Лекарства и токсины
1.1. Определенные
Аминорекс
Фенфлюрамин
Дексфенфлюрамин
Токсичное рапсовое масло
1.2. Очень вероятные
Амфетамины
L-триптофан
1.3. Вероятные
Мета-амфетамины
Кокаин
Химиотерапевтические препараты
1.4. Маловероятные
Антидепрессанты
Оральные контрацептивы
Эстрогеновые препараты
Курение табака
2. Демографические и медицинские состояния
2.1. Определенные
Пол
2.2. Возможные
Беременность
Системная гипертензия
2.3. Маловероятные
Ожирение
3. Заболевания
3.1. Определенные
ВИЧ-инфекция
3.2. Очень вероятные
Портальная гипертензия / болезни печени
Заболевания соединительной ткани
Врожденные шунты между системными и легочными сосудами
3.3. Вероятные
Патология щитовидной железы
Гематологические заболевания:
– Аспления после хирургической спленэктомии
– Серповидноклеточная анемия
– β-талассемия
– Хронические меилопролиферативные заболевания
Редкие генетические и метаболические нарушения
– Нарушение обмена гликогена типа 1а (болезнь фон Гирке)
– Болезнь Гоше
– Наследственная геморрагическая телеангиоэктазия (болезнь Рендю-Вебера-Ослера)
Новые возможные факторы риска включают гематологические заболевания, такие как аспления после хирургической спленэктомии, серповидноклеточная анемия, β-талассемия и хронические миелопролиферативные заболевания (истинная полицитемия, эссенциальная тромбоцитемия и миелофиброз с миелоидной метаплазией на фоне хронического миелолейкоза или миелодиспластического синдрома). К возможным факторам риска также относятся редкие генетические или обменные нарушения, такие как нарушение обмена гликогена типа 1а (болезнь фон Гирке), болезнь Гоше и наследственная геморрагическая телеангиоэктазия (болезнь Рендю-Вебера-Ослера).
Легочная вено-окклюзивная болезнь и легочной капиллярный гемангиоматоз
По "Эвианской классификации" ЛВОБ отнесена к легочной венозной гипертензии, которая включает преимущественно заболевания левых отделов сердца; ЛКГ включен в последнюю разнородную группу ЛГ, вызванной заболеваниями, поражающими непосредственно легочные сосуды. Сходство патоморфологических черт и клинических проявлений, наряду с возможным развитием отека легких во время терапии эпопростенолом, дает основания предположить, что эти состояния могут встречаться вместе. Соответственно этому представляется логичным объединить ЛВОБ и ЛКГ в одну категорию ЛАГ.
Фактически клинические проявления ЛВОБ и ЛКГ в целом похожи на ИЛАГ. Факторы риска и состояния, связанные с ЛАГ и ЛВОБ / ЛКГ, также сходные и включают склеродермию, ВИЧ-инфекцию, использование анорексигенов. Таким образом, в новой клинической классификации (см. табл. 1) группа 1 классификации ЛАГ имеет в составе подгруппу "ЛАГ, связанная со значительными изменениями вен или капилляров" (класс 1.4).
Классификация врожденных системно-легочных шунтов
Предлагаемая классификация врожденных системно-легочных шунтов учитывает тип и размер дефекта, наличие связанной с этим экстракардиальной патологии и состояние коррекции (табл. 3).
Таблица 3. Классификация врожденных системно-легочных шунтов
1. Тип
Простой
Дефект межпредсердной перегородки (ДМПП)
Дефект межжелудочковой перегородки (ДМЖП)
Открытый артериальный проток
Полный или частичный необструктивный аномальный легочный венозный возврат
Комбинированный
Описывается комбинация и определяется превалирующий дефект
Комплексный
Артериальный ствол
Единый желудочек с необструктивным легочным током крови
Дефекты межпредсердной и межжелудочковой перегородок
2. Размеры
Маленький (ДМПП ≤ 2 см и ДМЖП ≤ 1 см)
Большой (ДМПП >2 см и ДМЖП >1 см)
3. Связанная с шунтами экстракардиальная патология
4. Состояние коррекции
Нескорректированный
Частично скорректированный (возраст)
Скорректированный: спонтанно или хирургически (возраст)
Все эти факторы имеют отношение к развитию ЛГ, синдрома Эйзенменгера и прогнозу.
Синдром Эйзенменгера может быть вызван как простым, так и комплексным (около 30 % случаев) врожденным пороком сердца. Среди простых пороков наиболее часто встречаются дефекты межжелудочковой перегородки (ДМЖП), после них – дефекты межпредсердной перегородки (ДМПП) и незаращение артериального протока. Рассчитано, что у 10 % больных с ДМЖП любого размера старше 2 лет может развиться синдром Эйзенменгера, а у больных с ДМПП - в 4-6 % случаев. ЛАГ и заболевания легочных сосудов развиваются у больных с пороками больших размеров, почти у всех больных с артериальным стволом, в 50 % случаев ДМЖП и у 10 % больных с ДМПП. Среди больных с ДМПП частота ЛАГ выше у больных с дефектами венозного синуса (16 %) по сравнению с дефектом ostium secundum (открытое овальное окно) (4 %).
Развитие ЛАГ с патологией легочных сосудов, по-видимому, зависит от величины дефекта. Фактически, только у 3 % больных с небольшим или среднего размера ДМЖП развивается ЛАГ. Напротив, при большом размере дефекта (> 1,5 см в диаметре) ЛАГ развивается в 50 % случаев. При небольшом дефекте (ДМЖП < 1 см, ДМПП < 2 см эффективного диаметра, оцениваемого при эхокардиографии) точная патофизиологическая роль порока сердца в развитии легочной артериальной гипертензии не выяснена.
У некоторых больных тяжелая ЛАГ развивается после "успешной" коррекции порока сердца. Во многих таких случаях остается неясным, имелись ли необратимые повреждения легочных сосудов до хирургического вмешательства или заболевание легочных сосудов прогрессировало, несмотря на успешную коррекцию. Обычно рано проведенная коррекция предотвращает последующее развитие ЛАГ.
Патоморфология легочной артериальной гипертензии
ЛАГ включает различные формы ЛГ с разной этиологией, но со сходными клиническими проявлениями и во многих случаях со сходным ответом на лечение. Гистопатологические изменения при разных формах ЛАГ качественно одинаковые, но имеют количественные различия в распределении и преобладании патологических изменений различных компонентов сосудистой системы легких (артериолы, капилляры или вены). Приведенная ниже усовершенствованная патоморфологическая классификация была предложена на III Всемирном симпозиуме по ЛАГ в г. Венеции (табл. 4).
Таблица 4. Патоморфологическая классификация васкулопатий при легочной гипертензии
1. Легочная артериопатияа (пре- и интраацинарные артерии)
- легочная артериопатия с изолированной гипертрофией медии
- легочная артериопатия с гипертрофией медии и утолщением интимы (клеточное, фибротическое)
– концентрическое пластинчатое
– эксцентрическое, концентрическое непластинчатое
- легочная артериопатия с плексиформным повреждением и / или дилатацией или артериитом
- легочная артериопатия с изолированным артериитом
1а. Описанное выше, но с сопутствующими изменениями вен и венула (клеточное и / или фибротическое утолщение интимы, мускуляризация)
2. Легочная окклюзивная венопатияв (вен различного размера и венул) с сопутствующей артериопатией или без нее
3. Легочная микроваскулопатияс с сопутствующей артериопатией и / или венопатией или без них
4. Не классифицируемые изменения
Атипичные гистопатологические черты или недостаточный образец легочных сосудов
Примечание:
а– эти изменения типичны для групп 1.1. ИЛАГ, 1.2. СЛАГ и 1.3. АЛАГ клинической классификации (см. табл. 1);
в- эти изменения типичны для группы 1.4.1. ЛВОБ клинической классификации (см. табл. 1);
с- эти изменения характерны для группы 1.4.2. ЛКГ клинической классификации (см. табл. 1).
Легочная артериопатия
Основными гистопатологическими чертами легочной артериопатии являются
- гипертрофия медии,
- утолщение интимы и адвентиция
- комплексность повреждений
Гипертрофия медии – это увеличение площади поперечного сечения пре- и интраацинарных легочных артерий. Это обусловлено как гипертрофией, так и гиперплазией гладкомышечных волокон, а также увеличением соединительнотканного матрикса и эластических волокон в медии мышечных артерий.
Утолщение интимы может быть концентрическим пластинчатым, эксцентрическим и концентрическим непластинчатым. При ультраструктурном и иммуногистохимическом исследованиях клетки интимы имеют черты фибробластов, миофибробластов и гладкомышечных клеток.
Утолщение адвентиция появляется в большинстве случаев ЛАГ, но трудно поддается оценке.
Комплексное повреждение. Плексиформное повреждение – это локальная пролиферация эндотелиальных каналов, заполненных миофибробластами, гладкомышечными клетками и соединительнотканным матриксом. Эти повреждения локализуются в месте ветвления артерий или в месте отхождения дополнительной артерии, дистальнее места выраженного облитерирующего утолщения интимы основной артерии. Частота плексиформных повреждений при ЛАГ остается невыясненной. С плексиформными повреждениями может быть связан артериит, который характеризуется некрозом стенки артерии с фибриноидным пропитыванием и инфильтрацией воспалительными клетками.
Все вышеописанные изменения являются типичными для групп 1.1. (ИЛАГ), 1.2. (СЛАГ) и 1.3. (АЛАГ) клинической классификации (см. табл.1).
Легочная окклюзивная венопатия (легочная вено-окклюзивная болезнь)
На долю легочной окклюзивной венопатии приходится относительно небольшая часть всех случаев ЛГ; основные гистопатологические черты – распространенная диффузная окклюзия легочных венул и вен различного размера. Окклюзия просвета сосуда может быть сплошной или эксцентричной. Кроме того, может наблюдаться утолщение медии. При легочной окклюзивной венопатии обнаруживается большое количество гемосидерина как в цитоплазме альвеолярных макрофагов и альвеолоцитов II типа, так и в интерстиции. Капилляры переполняются кровью и выбухают, они могут быть настолько извилистыми, что иногда создают подобие легочного капиллярного гемангиоматоза. Легочные артериолы могут иметь черты ремоделирования с гипертрофией медии и фиброзом интимы. Плексиформные повреждения и фибриноидный артериит при легочной окклюзивной венопатии не описаны. Легочный интерстиций в междольковых перегородках часто отечный, при прогрессировании может развиваться интерстициальный фиброз. Лимфатические сосуды в легких и плевре также расширены. Эти изменения типичны для группы 1.4.1. клинической классификации (ЛВОБ, см. табл. 1).
Легочная микроваскулопатия (легочный капиллярный гемангиоматоз)
Легочная микроваскулопатия – другое редкое состояние, характеризующееся локальной пролиферацией легочных капилляров. Распределение легочной микроваскулопатии обычно панлобарное и очаговое. Патологически пролиферирующие капилляры инфильтрируют стенки артерий и вен, прорастая мышечный слой и перекрывая просвет сосуда. В участках пролиферации капилляров также присутствует легочный гемосидероз в виде макрофагов и альвеолоцитов II типа, нагруженных гемосидерином. Аналогично легочной окклюзивной венопатии, при легочной микроваскулопатии артерии легких имеют выраженную гипертрофию мышечного слоя и утолщение интимы. Эти изменения характерны для группы 1.4.2. клинической классификации (ЛКГ, см. табл. 1).
Патогенез легочной артериальной гипертензии
До настоящего времени точно неизвестны процессы, инициирующие патологические изменения, характерные для легочной артериальной гипертензии, несмотря на то, что сегодня мы знаем гораздо больше о механизмах, вовлеченных в этот процесс. Установлено, что ЛАГ имеет многофакторную патофизиологию, включающую различные биохимические реакции и типы клеток. Повышение ЛСС связано с различными механизмами, в том числе с вазоконстрикцией, обструктивным ремоделированием стенки легочных сосудов, воспалением и тромбозом.
Легочная вазоконстрикция, вероятно, является ранним компонентом процесса формирования ЛГ. Избыточная вазоконстрикция связана с патологической функцией калиевых каналов в гладкомышечных клетках и с эндотелиальной дисфункцией. У больных с ЛАГ в плазме снижается уровень вазодилататирующего и антипролиферативного вещества, каким является вазоактивный интестинальный пептид.
Эндотелиальная дисфункция приводит к хроническому снижению продукции вазодилататоров, таких как оксид азота (NO) и простациклин, наряду с избыточной выработкой вазоконстрикторов, таких как тромбоксан А2 (ТхА2) и эндотелин-1 (ЕТ-1). Многие из этих нарушений повышают сосудистый тонус и способствуют ремоделированию сосудов.
Процесс ремоделирования легочных сосудов охватывает все слои сосудистой стенки и характеризуется пролиферативными и обструктивными изменениями с участием нескольких типов клеток, включая эндотелиальные, гладкомышечные клетки и фибробласты. Кроме того, в адвентиции повышается продукция экстрацеллюлярного матрикса, в том числе коллагена, эластина, фибронектина и тенасцина. По-видимому, при легочной гипертензии в зависимости от тяжести заболевания стимулируется продукция ангиопоэтина-1, ангиогенного фактора, необходимого для развития сосудистой системы легких.
Также в развитии ЛАГ играют роль воспалительные клетки и тромбоциты. Фактически, воспалительные клетки участвуют во всех патологических изменениях при ЛАГ, и в плазме больных с ЛАГ повышается уровень провоспалительных цитокинов. Также у больных ЛАГ выявляется нарушение метаболизма серотонина, легочного вазоконстрикторного вещества, депонированного в тромбоцитах.
У больных ЛАГ выявляются протромботические нарушения, и тромбы присутствуют как в микроциркуляторном русле, так и в эластических легочных артериях. Фактически, у больных ИЛАГ повышены уровни как фибропептида А, что отражает активность тромбина, так и ТхА2.
Несмотря на выявление мутаций в BMPR2 в большинстве случаев СЛАГ, патобиологические связи между генетическими нарушениями и развитием легочного сосудистого гипертензивного заболевания не подтверждены. С другой стороны, высокая частота "истинной" спорадической ИЛАГ и снижение распространенности СЛАГ (проявления заболевания развиваются только в 20 % случаев мутации гена BMPR2) позволяют предположить, что для развития заболевания требуются дополнительные триггеры. Этими механизмами могут быть вторичные соматические мутации при нестабильном BMPR2, полиморфизм генов, связанных с ЛАГ (ген-транспортер серотонина 5НТТ, ген NO-синтазы (ес-NOS) и ген карбамил-фосфатсинтазы (CPS)) или любые воздействия, способные нарушать контроль роста клеток легочных сосудов. Кроме того, могут существовать другие, пока неизвестные гены, имеющие отношение к цепочке BMP / TGF-βv. На самом деле мутации рецепторов TGF-βv, активин-рецептороподобной киназы 1 (ALK-1) и эндоглина выявляются у больных ЛАГ с индивидуальным или семейным анамнезом наследственной геморрагической телеангиоэктазии, или болезни Рендю-Вебера-Ослера.
Несмотря на то, что при ЛАГ установлены многие патобиологические механизмы в клетках и тканях, точные взаимодействия этих механизмов в инициации и прогрессировании патологических процессов изучены недостаточно хорошо. Вероятные теоретические взаимосвязи включают классические взаимоотношения между генетической предрасположенностью и факторами риска, которые могут индуцировать изменения в клетках различных типов (гладкомышечные, эндотелиальные, воспалительные клетки, тромбоциты) и в экстрацеллюлярном матриксе легочной системы микроциркуляции.
Дисбаланс между тромбогенными, митогенными, провоспалительными и вазоконстрикторными факторами в противоположность антикоагулянтным, антимитотическим и вазодилатирующим механизмам могут инициировать и закреплять такие процессы, как вазоконстрикция, пролиферация, тромбоз и воспаление в системе легочной микроциркуляции. Эти механизмы ответственны за возникновение и прогрессирование патологических обструктивных изменений, типичных для ЛАГ. Последующее нарастание ЛСС ведет к перегрузке правого желудочка и затем к правожелудочковой недостаточности и смерти.
Для выяснения, какие из этих нарушений являются причиной ЛАГ и на какие лучше всего направлять лечение этого заболевания, требуются дальнейшие исследования.
Диагностика легочной гипертензии
Процесс диагностики ЛГ требует проведения ряда исследований, направленных на установление диагноза, определение клинического класса ЛГ и типа ЛАГ и оценку функциональных и гемодинамических нарушений. На практике удобно использовать последовательный подход, состоящий из 4 этапов:
I. Клиническое подозрение о ЛГ
II. Установление диагноза ЛГ
III. Определение клинического класса ЛГ
IV. Оценка типа ЛАГ, физической толерантности, гемодинамики
Клиническое подозрение о легочной гипертензии
Клиническое подозрение о ЛГ должно возникать в любом случае одышки без явных признаков сердечного или легочного заболевания или у больных с имеющимся заболеванием сердца или легких при нарастании одышки, которое нельзя объяснить этим заболеванием. Симптомы легочной гипертензии также включают
- утомляемость
- слабость
- ангинозные боли в грудной клетке
- синкопальные состояния
- вздутие живота
Симптомы в покое появляются только в далеко зашедших случаях.
Физикальные признаки ЛГ могут потребовать определенного опыта для их оценки. К ним относятся
- усиление сердечных тонов по левой парастернальной линии
- усиление легочного компонента II тона
- пансистолический шум трикуспидальной регургитации
- диастолический шум недостаточности легочных клапанов
- правожелудочковый III тон.
Набухание шейных вен, гепатомегалия, периферические отеки, асцит и похолодание конечностей характерны для более развернутой стадии заболевания с признаками правожелудочковой недостаточности в покое. Также может иметь место центральный цианоз (а иногда периферический и смешанный цианоз). Аускультация легких, как правило, не выявляет изменений.
Клиническое подозрение о ЛГ появляется, когда эти признаки возникают на фоне состояния, которое может сопровождаться ЛАГ, например, ЗСТ, портальной гипертензии, ВИЧ-инфекции, врожденных пороков сердца с системно-легочными шунтами. При наличии этих предрасполагающих заболеваний некоторые эксперты высказываются за периодическое скрининговое обследование таких больных с целью выявления асимптоматической ЛГ на ранней ее стадии (см. ниже раздел "Особые состояния").
Наконец, ЛГ может быть заподозрена при изменениях электрокардиограммы, рентгенограммы органов грудной клетки или при эхокардиографии, которые выполнялись по другим клиническим причинам.
Установление диагноза легочной гипертензии
Этот этап требует проведения исследований, которые способны подтвердить диагноз ЛГ. К таким исследованиям относятся ЭКГ, рентгенограмма органов грудной клетки и допплер-эхокардиография (Д-ЭхоКГ).
ЭКГ
ЭКГ может дать предположительную или подтверждающую информацию о ЛГ при появлении гипертрофии и растяжения правого желудочка и дилатации правого предсердия. Гипертрофия правого желудочка выявляется на ЭКГ у 87 % больных, а отклонение электрической оси сердца вправо – у 79 % больных с ИЛАГ.
Однако ЭКГ недостаточно чувствительна (55 %) и специфична (70 %), чтобы быть скрининговым методом для диагностики ЛАГ. Нормальная ЭКГ не исключает наличия тяжелой ЛАГ.
Рентгенограмма органов грудной клетки
У 90 % больных с ИЛАГ в момент постановки диагноза имеются изменения на рентгенограмме органов грудной клетки. Они включают расширение легочной артерии, которая при контрастировании "теряет" периферические ветви. Также можно увидеть увеличение правых предсердия и желудочка, которое прогрессирует в развернутой стадии заболевания. Рентгенография органов грудной клетки позволяет достаточно надежно исключить связанные с ЛГ среднетяжелые и тяжелые заболевания легких и легочную венозную гипертензию, обусловленную патологией левых отделов сердца. Однако нормальная рентгенограмма органов грудной клетки не исключает легкую посткапиллярную легочную гипертензию на фоне заболеваний левых отделов сердца или ЛВОБ.
Допплер-эхокардиография
Д-ЭхоКГ является превосходным неинвазивным скрининговым методом для больных с подозрением на ЛГ. Д-ЭхоКГ позволяет оценить систолическое давление в легочной артерии (сДЛА) и может дать дополнительную информацию о причине и последствиях ЛГ. При отсутствии обструкции выходного отдела правого желудочка сДЛА эквивалентно систолическому давлению в правом желудочке (сДПЖ). сДПЖ рассчитывается при измерении скорости потока систолической регургитации на уровне трехстворчатого клапана V и давления в правом предсердии (ДПП) по формуле:
сДПЖ = 4v2+ ДПП
ДПП – либо стандартизованная величина, либо рассчитывается по параметрам нижней полой вены или величине расширения яремной вены. Поток трикуспидальной регургитации можно измерить у большинства больных ЛГ (74 %) . В большинстве исследований получена выраженная корреляция (0,57-0,93) между величинами сДЛА, измеренными при Д-ЭхоКГ и при катетеризации правых отделов сердца. Однако для минимизации ложноположительных результатов важно определить при Д-ЭхоКГ специфические показатели, подтверждающие диагноз ЛГ.
Разброс сДПЖ у здоровых лиц хорошо изучен. В большой популяции мужчин и женщин в возрасте от 1 до 89 лет сДПЖ было 28 ± 5 мм рт. ст. (разброс 15-57 мм рт. ст.). сДПЖ повышается с возрастом и увеличением индекса массы тела. В соответствии с этими данными легкую ЛГ можно определить как сДПЖ примерно 36-50 мм рт. ст. или скорость трикуспидальной регургитации в покое 2,8-3,4 м/с (принимая за норму ДПП 5 мм рт. ст.). Следует заметить, что такое определение влечет в некотором числе случаев гипердиагностику ЛГ, особенно у пожилых, и при наличии клинической картины ЛГ (класс II-III по Нью-Йоркской классификации Ассоциации сердца - NYHA) необходимо подтвердить диагноз с помощью катетеризации правых отделов сердца. У асимптоматических больных (класс I по NYHA) следует исключать сопутствующие ЗСТ и повторить ЭхоКГ через 6 мес. Необходимо иметь в виду, что установление повышенного сДПЖ не определяет точку, в которой повышенное сДПЖ становится клинически значимым, прогнозирует дальнейшие последствия этого повышения и / или требует специфической терапии. Также следует принимать во внимание возможность ложноотрицательных результатов Д-ЭхоКГ даже при больших клинических подозрениях.
При подтверждении диагноза ЛГ и оценке ее тяжести важную роль играют дополнительные допплер-эхокардиографические параметры, в том числе размеры и функция правого и левого желудочков, изменения трикуспидального, митрального клапанов и клапана легочной артерии, фракция выброса правого желудочка и параметры наполнения левого желудочка, размеры нижней полой вены и перикардиальный выпот.
Помимо выявления ЛГ, Д-ЭхоКГ позволяет провести дифференциальную диагностику возможных причин ЛГ и начать фазы III и IV диагностического процесса. Д-ЭхоКГ может выявить патологию клапанов и миокарда левых отделов сердца, которые становятся причиной легочной венозной гипертензии (клинический класс 2), врожденные пороки сердца с системно-легочными шунтами (клинический класс 1.3.2). Внутривенное введение контрастного вещества может выявить незаращенное овальное окно или небольшой дефект межпредсердной перегородки по типу венозного синуса, которые можно пропустить при стандартной Д-ЭхоКГ.
Потребность в чреспищеводной эхокардиографии (ЧП-ЭхоКГ) возникает редко, это исследование обычно используется для подтверждения наличия и оценки точного размера маленького дефекта межпредсердной перегородки.
Определение клинического класса легочной гипертензии
Следующим шагом после установления диагноза ЛГ является определение клинического класса в соответствии с Венецианской клинической классификацией. Это требует применения обязательных методов исследования, таких как Д-ЭхоКГ (как описано выше), легочных функциональных тестов, в том числе исследования газового состава артериальной крови, и вентиляционно-перфузионного (V / Q) сканирования легких. При необходимости в отдельных ситуациях могут использоваться дополнительные методы, такие как компьютерная томография легких (КТ) легких высокого разрешения (КТВР), спиральная КТ, ангиография легочных сосудов.
Легочные функциональные тесты и исследование газового состава артериальной крови
Легочные функциональные тесты и газовый анализ артериальной крови могут оценить вклад лежащих в основе ЛГ заболеваний дыхательных путей или легочной паренхимы. У больных с ЛАГ обычно снижена диффузионная способность легких по монооксиду углерода (DLco) (как правило, в пределах 40-80 %долж.) и уменьшены легочные объемы в легкой или умеренной степени. В результате альвеолярной гипервентиляции напряжение кислорода в артериальной крови (РаО2) может слегка снижаться или оставаться нормальным, а напряжение углекислого газа в артериальной крови (РаСО2) снижается.
Хроническая обструктивная болезнь легких (ХОБЛ) как причина гипоксической ЛГ диагностируется на основании необратимой бронхиальной обструкции, выявляемой обычно при измерении объема форсированного выдоха за 1-ю секунду (ОФВ1). Такие больные наряду с ограничением воздушного потока и увеличением остаточного объема часто имеют нормальное или повышенное РаСО2 и снижение DLcо. Эмфизема сегодня диагностируется с помощью КТВР. Снижение легочных объемов при одновременном снижении DLco может означать наличие интерстициального заболевания легких (ИЗЛ). КТВР является основным способом оценки тяжести ИЗЛ. При клиническом подозрении на обструктивное апноэ / гипопноэ сна и десатурацию в ночное время проводится скрининговая оксиметрия и полисомнография в течение ночи.
Вентиляционно-перфузионное (V / Q) сканирование легких
При ЛАГ V / Q сканирование может быть полностью нормальным. Однако это исследование может выявить маленькие периферические несегментарные дефекты перфузии. Эти участки нормально вентилируются, следовательно, соотношение V / Q будет изменено. V / Q сканирование легких является способом диагностики хронической тромбоэмболической легочной гипертензии (ХТЭЛГ, клинический класс 4). При ХТЭЛГ дефекты перфузии обычно располагаются на долевом и сегментарном уровне, что отражается сегментарными дефектами перфузии при ее графическом изображении. Поскольку эти участки вентилируются нормально, то дефекты перфузии не совпадают с дефектами вентиляции. При дифференциальной диагностике ИЛАГ и ХТЭЛГ V/Q сканирование легких обладает высокой чувствительностью (90-100 %) и специфичностью (94-100 %). Однако дефекты перфузии, не совпадающие с вентиляционными, также могут выявляться при ЛВОБ. Такие пациенты нуждаются в тщательном дальнейшем обследовании (см. раздел по КТВР). У больных с паренхиматозными заболеваниями легких дефекты перфузии совпадают с вентиляционными дефектами.
КТВР легких
КТВР дает детальную информацию о состоянии легочной паренхимы и облегчает диагностику ИЗЛ и эмфиземы. Наличие интерстициальных признаков, сходных с теми, что встречаются при левожелудочковой недостаточности, таких как диффузные центральные затемнения по типу "матового стекла" и утолщение междольковых перегородок, позволяет заподозрить ЛВОБ; дополнительными признаками являются лимфоаденопатия, плевральные затемнения и выпот. Диффузное двухстороннее утолщение междольковых перегородок и наличие маленьких центрилобулярных округлых затемнений с нечетким контуром дает основание предположить ЛКГ.
Спиральная КТ легких с контрастным усилением, ангиография легочных сосудов и магнитно-резонансная томография
Спиральная КТ легких с контрастным усилением показана больным с ЛГ, у которых V / Q сцинтиграфия легких выявила сегментарные или субсегментарные дефекты перфузии при нормальной вентиляции, т. е. получено изменение V / Q соотношения, что может быть свидетельством хронической тромбоэмболии легких. КТ признаками хронической тромбоэмболической болезни являются полная окклюзия легочных артерий, дефекты наполнения после тромбов, реканализация и стенозы, или сетчатость.
Традиционная ангиография легких по-прежнему необходима в диагностике ХТЭЛГ для лучшего выявления больных, которым показана эндартериоэктомия. Легочная ангиография более точная для выявления дистальной обструкции сосудов и также показана в случаях сомнительного результата спиральной КТ с контрастированием у больных с клиническим и сцинтиграфическим подозрением на ХТЭЛГ. Эта процедура достаточно безопасна даже для больных с тяжелой ЛГ при выполнении опытными сотрудниками. Полезные технические детали включают использование современных контрастных препаратов, раздельное введение в правую и левую ветвь и множественные снимки.
С возрастающей частотой у больных с ЛАГ применяется магнитно-резонансная томография для оценки патологических и функциональных изменений как сердечной, так и легочной циркуляции. Однако необходимо накопление дополнительного опыта, прежде чем сделать это исследование рутинным для больных с ЛАГ.
Оценка легочной артериальной гипертензии (тип, физическая толерантность, гемодинамика)
После того, как определен клинический класс ЛАГ (клинический класс 1), могут потребоваться дополнительные исследования для точного определения типа ЛАГ и для оценки физической толерантности и гемодинамики.
Исследование крови и иммунология
Необходимы рутинный общий и биохимический анализы крови и исследование функции щитовидной железы. Следует также выполнить скрининговое обследование на тромбофилию, включающее антифосфолипидные антитела (волчаночный антикоагулянт, антитела к кардиолипину). ЗСТ диагностируются первоначально по клиническим и лабораторным критериям и по аутоиммунному скринингу, включающему антинуклеарные антитела (АНА), к которым относятся антицентромерные антитела, анти-SCL70 и рибонуклеарный протеин (RNP).
Около трети больных с ИЛАГ имеют положительный, но низкий титр АНА (< 1 : 80) . Больные со значительным повышением АНА и / или с клинической картиной, подозрительной в отношении ЗСТ, нуждаются в дальнейшем серологическом обследовании и консультации ревматолога. Наконец, все больные должны быть обследованы на ВИЧ-инфекцию.
Ультразвуковое обследование органов брюшной полости
Цирроз печени и / или портальную гипертензию можно надежно исключить при ультразвуковом исследовании органов брюшной полости. Использование цветного допплера также помогает отличить пассивную портальную гипертензию в результате правожелудочковой недостаточности от портальной гипертензии, вызванной повышением транспеченочного венозного градиента на фоне цирроза печени. Использование контрастных веществ улучшает диагностику. Диагноз портальной гипертензии можно подтвердить, определив повышенный градиент между свободным давлением и давлением заклинивания в печеночной вене при катетеризации правых отделов сердца (см. раздел "Порто-пульмональная гипертензия").
Физическая толерантность
Объективная оценка толерантности к физической нагрузке у больных с ЛАГ является важным способом установления тяжести болезни и эффективности лечения. Наиболее часто при ЛГ используются такие нагрузочные тесты как тест с 6-минутной ходьбой (6МТ) и кардиопульмональное нагрузочное тестирование (КПНТ) с оценкой параметров газообмена.
Тест с 6-минутной ходьбой (6МТ) является недорогим и технически простым методом. Он прогнозирует выживаемость при ИЛАГ и отрицательно коррелирует с оценкой функционального статуса по NYHA. При проведении 6МТ обычно используют шкалу Борга, которая определяет субъективную степень тяжести одышки на фоне физической нагрузки. Снижение сатурации артериальной крови > 10 % во время 6МТ в 2,9 раз увеличивает риск летального исхода в течение 26 мес. в среднем. 6МТ является традиционным "первичным" конечным показателем в большинстве клинических контролируемых исследований у больных с ЛАГ.
Кардиопульмональное нагрузочное тестирование (КПНТ) позволяет измерять показатели вентиляции и газообмена во время физической нагрузки, что дает дополнительную патофизиологическую информацию помимо той, которую обычно получают при стандартном нагрузочном тестировании. У больных с ЛАГ, как правило, снижаются пиковое VO2, пиковая мощность работы, соотношение динамики VO2 к динамике мощности работы на фоне нагрузки, анаэробный порог и пиковый кислородный пульс; у них увеличиваются легочная вентиляция VE и VCO2, отражающие неэффективности вентиляции. Пиковое VO2 коррелирует с прогнозом у больных ЛАГ. КПНТ использовалось в недавно проведенных мультицентровых исследованиях, но этот тест не подтвердил улучшение, полученное при 6МТ. Возможное объяснение этому факту состоит в том, что КПНТ технически более сложное исследование, чем 6МТ, и результаты КПНТ могли зависеть от опыта исследователей. Другое объяснение заключалось в недостаточной чувствительности КПНТ при оценке эффективности лечения, которая могла быть менее выражена при максимальных нагрузках по сравнению с субмаксимальными.
Гемодинамика
Для подтверждения диагноза ЛАГ, оценки тяжести гемодинамических изменений и исследования реактивности сосудов малого круга кровообращения необходима катетеризация правых отделов сердца. При этом всегда следует оценивать следующие параметры:
- частоту сердечных сокращений (ЧСС)
- ДПП
- ДЛА (систолическое, диастолическое и среднее)
- давление заклинивания в легочных капиллярах (ЛДЗ),
- сердечный выброс (путем термодилюции или методом Фика в случаях системно-легочных шунтов)
- кровяное давление
- легочное и системное сосудистое сопротивление,
- сатурацию кислорода артериальной и смешанной венозной крови (и сатурацию в верхней полой вене в случаях системно-легочных шунтов).
Диагноз ЛАГ выставляют при среднем ДЛА > 25 мм рт. ст. в покое или > 30 мм рт. ст. при физической нагрузке, ЛДЗ < 15 мм рт. ст. и ЛСС > 3 мм рт. ст./л/мин (единицы Вуда).
Катетеризация левых отделов сердца требуется в редких ситуациях, когда нельзя надежно измерить ЛДЗ. Подтверждение диагноза путем катетеризации правых отделов сердца требуется у пациентов с клинической картиной ЛГ (классы II и III по NYHA) с легкой ЛГ при оценке по Д-ЭхоКГ (см выше) с целью выявления больных, которым необходимы дальнейшие диагностические исследования и лечение. Измерение ЛДЗ помогает различить артериальную и венозную ЛГ у больных с сопутствующим поражением левых отделов сердца. Катетеризация правых отделов сердца также важна для больных с уже установленным диагнозом среднетяжелой и тяжелой ЛАГ в связи с тем, что гемодинамические параметры имеют прогностическое значение.
Повышение среднего ДПП, среднего ДЛА, снижение сердечного выброса и центральной венозной сатурации кислорода связано с наиболее неблагоприятным прогнозом у больных с ИЛАГ. Измерение гемодинамических показателей позволяет установить патогенез ИЛАГ у конкретного больного, рассчитав формулу прогноза, которую также применяют для оценки отдаленных результатов новых методов лечения или выживаемости. Однако эта формула была выведена почти 15-20 лет назад и не вполне подходит для нынешней популяции больных ЛАГ.
Результаты неконтролируемых исследований допускают, что длительное назначение антагонистов кальция увеличивает выживаемость в редких случаях "остро" реагирующих на это лечение больных по сравнению с не ответившими на терапию. В целом принято, что больных, у которых возможен благоприятный прогноз в результате длительного лечения антагонистами кальция, можно выявить при остром вазодилатационном тесте во время катетеризации правых отделов сердца. Однако предполагается, что для полной уверенности в таком прогнозе необходима и положительная реакция в остром тесте на вазореактивность, и стабильный эффект от длительного лечения антагонистами кальция.
Для снижения риска возможных осложнений острый вазодилатационный тест следует проводить, используя только легочные вазодилататоры короткого действия во время первой катетеризации правых отделов сердца в клинических центрах, имеющих опыт таких исследований. В настоящее время для острого теста используют внутривенный простациклин или аденозин и ингаляционный NO. Периоды полувыведения, дозы и длительность введения приведены в табл. 5.
Таблица 5. Способы введения, период полувыведения, дозы и длительность назначения наиболее часто используемых препаратов для легочных вазодилатационных тестов
| Препарат | Путь введения | Дозыа | Повышение дозб | Длительность введенияв |
|---|---|---|---|---|
| Эпопростен | внутривенно | 2-12 нг/кг/мин | 2 нг/кг/мин | 10 мин |
| Аденозин | внутривенно | 50-350 мкг/кг/мин | 50 нг/кг/мин | 2 мин |
| NO | ингаляционно | 10-20 ppm | - | 5 минд |
Примечание:
а– приведены первоначальная и максимальная дозы;
б– ступенчатое повышение дозы на указанную величину;
в– длительность каждой ступени;
д– доза NO повышается однократно в указанных пределах.
Реакция в остром тесте на вазореактивность считается положительной, если среднее ДЛА снижается на > 10 мм рт. ст. и достигает абсолютной величины < 40 мм рт. ст. при повышении или неизменной величине сердечного выброса (больные с положительной острой реакцией). Такой результат наблюдается только у 10-15 % больных с ИЛАГ. У больных с положительной острой реакцией более вероятен стабильный положительный эффект от длительного лечения высокими дозами антагонистов кальция, и это единственная категория больных, которых можно безопасно лечить этими препаратами.
Эмпирическое назначение антагонистов кальция без проведения острого теста на вазореактивность крайне нежелательно из-за возможных тяжелых побочных эффектов.
Больные с положительной долговременной реакцией на высокие дозы антагонистов кальция – это больные с I или II функциональным классом по NYHA и почти нормальными показателями гемодинамики после нескольких месяцев монотерапии антагонистами кальция. Только около половины больных с ИЛАГ, положительно ответивших на острый вазодилатационный тест, положительно отвечают и на длительное лечение антагонистами кальция, и только в этих случаях допускается продолжение лечения антагонистами кальция в качестве монотерапии.
Целесообразность острого теста на вазореактивность и длительного лечения антагонистами кальция больных с ЛАГ на фоне ЗСТ или врожденных пороков сердца менее изучена по сравнению с ИЛАГ. Однако эксперты полагают, что у этих больных также следует проводить острый тест на вазореактивность и в соответствующих случаях оценивать эффект длительного лечения антагонистами кальция.
Биопсия легких
Открытая или торакоскопическая биопсия легких сопровождается значительным риском осложнений и летального исхода. В связи с низкой вероятностью влияния результатов этой процедуры на диагноз и лечение рутинное проведение биопсии легких нежелательно.
Оценка тяжести легочной гипертензии
Показано, что определить прогноз больных с ИЛАГ можно по нескольким показателям, оцененным исходно и после целенаправленного лечения. Для других видов ЛАГ, таких как ЛАГ на фоне ЗСТ, врожденных системно-легочных шунтов, ВИЧ-инфекции и портальной гипертензии, получено очень мало информации. В этих ситуациях на исход заболевания могут влиять дополнительные факторы. Фактически, больные с ЛАГ на фоне ЗСТ имеют более неблагоприятный прогноз, чем больные с ИЛАГ, а ЛАГ на фоне врожденных системно-легочных шунтов прогрессирует медленнее, чем ИЛАГ. В практике прогностическое значение одиночного показателя у конкретного больного меньше, чем нескольких конкордантных признаков (табл. 6).
Таблица 6. Прогностические показатели при ИЛАГ
Клинические показатели
Функциональный класс по NYHA
Функциональный класс по NYHA на фоне длительного лечения эпопростенолом
Правожелудочковая недостаточность в анамнезе
Толерантность к физической нагрузке
Расстояние, пройденное в 6МТ
Расстояние, пройденное в 6МТ, на фоне длительного лечения эпопростенолом
Пиковое VO2
Эхокардиографические показатели
Перикардиальный выпот
Размер правого предсердия
Индекс эксцентричности левого желудочка
Допплеровский индекс правого желудочка (индекс Tei)
Гемодинамические показатели
Давление в правом предсердии
Среднее ДЛА
Сердечный выброс
Смешанная венозная сатурация кислорода
Положительная реакция в остром вазодилатационном тесте
Снижение ЛСС < 30 % через 3 мес. лечения эпопростенолом
Показатели крови
Гиперурикемия
Исходный уровень мозгового натрийуретического пептида
Уровень мозгового натрийуретического пептида через 3 мес. лечения эпопростенолом
Тропонин
Норадреналин плазмы
Эндотелин-1 плазмы
Клинические показатели
Среди клинических показателей у больных с ИЛАГ, получающих традиционное лечение, четкое прогностическое значение имеет исходный функциональный класс по NYHA. Прогностическое значение этого признака сохраняется и через 3 мес. лечения эпопростенолом. Наличие правожелудочковой недостаточности до начала лечения эпопростенолом является негативным прогностическим фактором. Классификация Всемирной Организации Здравоохранения (ВОЗ), предложенная в г. Эвиане, адаптировала классификацию NYHA для больных ЛАГ (функциональная классификация NYHA / ВОЗ), и многие клиницисты используют обе классификации, которые почти идентичны (табл. 7).
| Класс | Описание |
|---|---|
| I | Больные с ЛГ без ограничений обычной физической активности; обычная физическая активность не вызывает усиления одышки, утомляемости, болей в грудной клетке или предобморочных состояний |
| II | Больные с ЛГ, имеющие легкое ограничение физической активности. Они не ощущают дискомфорта в покое, но нормальная физическая активность вызывает усиление одышки, утомляемость, боли в грудной клетке или предобморочные состояния |
| III | Больные с ЛГ с выраженным ограничением физической активности. В покое дискомфорта нет, но при нагрузках меньше обычных усиливается одышка, появляются утомляемость, боли в грудной клетке или предобморочные состояния |
| IV | Больные с ЛГ, которые не могут переносить никакую физическую нагрузку и у которых в покое могут быть признаки правожелудочковой недостаточности. Одышка и / или утомляемость также могут присутствовать в покое, и симптомы усиливаются почти при любой физической активности |
Толерантность к физической нагрузке
Несколько исследователей показали, что большое прогностическое значение при ЛАГ имеет 6МТ: Miyamoto et al. продемонстрировали, что больные с ИЛАГ, проходившие менее 332 м, имели значительную более низкую выживаемость по сравнению с теми, кто проходил большее расстояние. В другом исследовании рассчитано, что у больных с ИЛАГ при увеличении пройденного расстояния на 50 м риск летального исхода уменьшался на 18 %. Предварительные данные показали, что десатурация артериальной крови > 10 % во время 6МТ повышала риск летального исхода в течение среднего периода наблюдения в 26 мес. в 2,9 раза. У больных с III или IV функциональным классом по NYHA, проходивших < 250 м до начала лечения эпопростенолом или < 380 м через 3 мес. лечения эпопростенолом, прогноз был хуже, чем у больных, проходивших большее расстояние. Абсолютное изменение в расстоянии, пройденном за 6 мин, на фоне лечения эпопростенолом, не имело прогностического значения.
Пиковое VO2 < 10,4 мг/кг/мин, измеренное при КПНТ, коррелировало с худшим прогнозом у больных с ЛАГ.
Эхокардиографические показатели
Наличие перикардиального выпота и его размеры, оцененные при Д-ЭхоКГ, имеют четкое отношение к прогнозу у больных ИЛАГ. Кроме того, размеры правого предсердия и индекс эксцентричности левого желудочка прогнозируют исход у больных с ИЛАГ [89].
Допплеровский правожелудочковый индекс, или индекс Tei, - показатель, оценивающий как систолическую, так и диастолическую функцию правого желудочка, также имеет прогностическое значение при ЛАГ.
Показатели гемодинамики
Исходно повышенные средние ДПП и ДЛА, как и снижение сердечного выброса и центральной венозной сатурации кислорода, означают наиболее неблагоприятный прогноз при ИЛАГ. Больные с положительным острым тестом на вазореактивность имеют лучший прогноз, чем больные с отрицательной острой реакцией на вазодилататоры.
При однофакторном анализе исходными гемодинамическими показателями, связанными с неблагоприятным исходом у больных ИЛАГ, в последующем получавших лечение эпопростенолом, были ДПП > 12 мм рт. ст. и среднее ДЛА < 65 мм рт. ст., даже несмотря на то, что последний показатель не был подтвержден другими исследователями. Снижение ЛСС < 30 % относительно исходного уровня через 3 мес. лечения эпопростенолом также было связано с плохим прогнозом.
Исследование крови
У больных с ЛГ часто выявляется гиперурикемия, что коррелирует с гемодинамическими нарушениями (повышением ДПП) и повышенной летальностью при ИЛАГ. Мозговой натрийуретический пептид повышается при перегрузке давлением правого желудочка и коррелирует со степенью тяжести правожелудочковой дисфункции и летальностью при ЛАГ.
С выживаемостью коррелируют и дополнительные нейрогормональные показатели плазмы, например норадреналин и ЭТ-1. Недавно было показано, что уровень тропонина, как исходный, так и после целенаправленного лечения, имеет прогностическое значение у больных с ЛАГ.
Лечение
Лечение ЛАГ традиционно имеет всего несколько трудноосуществимых вариантов. Сегодня мы наблюдаем переход от медленного прогресса в этой области, занявшего несколько десятилетий, к большому числу РКИ, выполненных в последние несколько лет. В то же время существуют различные методы лечения, которые, согласно всеобщему мнению, являются эффективными (например, пероральные антикоагулянты, кислород, антагонисты кальция), хотя их эффективность не доказана в РКИ, и которые формально не имеют специфических показаний для назначения при ЛАГ.
Целью данного раздела является обзор всех видов лечения в соответствии с классификацией уровней доказательности, как рекомендуется Комитетом ESC по практическим руководств. Кроме того, мы публикуем классификацию рекомендаций, учитываемую при оценке клинической эффективности методов лечения, которые по различным причинам не были исследованы в РКИ, например, пероральных коагулянтов, кислорода, антагонистов кальция, баллонной предсердной септостомии и / или трансплантации легких.
В конце мы предлагаем алгоритм лечения ЛАГ, основанный на доказательствах, который описывает показания для каждого метода лечения.
Предисловие к уровням доказательности и классификации рекомендаций
Система определения уровня доказательности во многом основана на числе РКИ, положительно оценивающих данную стратегию лечения (табл. 8), и учитывает особые требования для редко встречающихся заболеваний.
Таблица 8. Уровни доказательства эффективности
| Уровень А | Данные получены из множественных РКИ или метаанализов |
| Уровень В | Данные получены из единственного РКИ или множественных исследований с гетерогенными результатами |
| Уровень С | Соглашение (консенсус) или мнение экспертов и / или маленькие исследования, ретроспективные исследования, регистры |
Единственная разница состоит в том, что мы не включили в группу В нерандомизированные исследования, поскольку все исследования по ЛАГ имеют небольшие размеры и, следовательно, они отнесены в группу С. В группу В включена категория "множественные РКИ с гетерогенными результатами", так как такая ситуация может возникнуть (и возникала), и эта формулировка более универсальная, даже если проведено единственное РКИ с положительным результатом. Анализ учитывал исследования и РКИ с участием больных с ЛАГ, опубликованные в реферативных журналах или представленные на недавних крупных совещаниях.
Система классификации уровней доказательности, основанная на числе РКИ, может иметь некоторые ограничения, которые следует учитывать и по возможности корректировать. Фактически, по мере проведения новых исследований уровень доказательности со временем может меняться. Кроме того, система классификации не определяет размер РКИ как маленький, если его вес такой же, как РКИ большего размера. Кроме того, в отношении эффективности уровни доказательности не следует путать с уровнем клинической эффективности, который зависит от фармакодинамических эффектов действующего вещества и от его возможных побочных эффектов и недостатков (например сложный путь введения). Так, метод лечения с более хорошим результатом, но оцененный только в одном или ни в одном РКИ, будет отнесен соответственно к группе В или С по сравнению с методом, имеющим худший результат и больше побочных эффектов, но оцененным более чем в одном РКИ, который будет отнесен к группе А. Органы фармакологического контроля могут дать разрешение для использования данного лечебного метода на основании единственного РКИ с достаточным размером выборки.
Соответственно этому классификация рекомендаций (табл. 9) основана на уровнях клинической эффективности.
Таблица 9. Классификация рекомендаций
| Класс I | Доказательства и / или общее соглашение, что данная диагностическая процедура / метод лечения являются выгодными, эффективными, полезными |
| Класс II | Противоречивые доказательства и / или расхождение мнений о целесообразности / эффективности метода лечения |
| Класс IIа | Вес доказательства / мнения склоняется в пользу целесообразности / эффективности |
| Класс IIб | Целесообразность / эффективность в меньшей степени подтверждена доказательствами / мнением экспертов |
| Класс IIIа | Доказательство или общее соглашение, что лечение не полезно / неэффективно и в некоторых случаях может принести вред |
а– использование класса III не рекомендуется ESC
Наконец, обе составляющие классификации рекомендаций и уровней доказательности дают полную характеристику каждого вида лечения (табл. 10).
Таблица 10. Классификация рекомендаций и уровней доказательств эффективности при ИЛАГ
| Вид лечения | Класс рекомендаций | Уровень доказательства | ||
|---|---|---|---|---|
| I | IIа | IIб | ||
| Общие мероприятия | Х | С | ||
| Пероральные антикоагулятнтыа | Х | С | ||
| Диуретики | Х | С | ||
| Дигоксин | Х | С | ||
| Кислородб | Х | С | ||
| Антагонисты кальцияв | Х | С | ||
| Эпопростенол | Х | А | ||
| Трепростинол | Х | В | ||
| Илопрост (ингаляционный) | Х | В | ||
| Илопрост (внутривенный) | Х | С | ||
| Берапрост | Х | В | ||
| Босентан | Хг | А | ||
| Ситанксентанд | В | |||
| Амбрисентанд | С | |||
| Силденафил | Х | А | ||
| Комбинированная терапия | Х | С | ||
| Баллонная предсердная септотомия | Х | С | ||
| Трансплантация легких | Х | С | ||
Примечание:
а– IIа для ИЛАГ, IIб для других форм ЛАГ;
б– если сатурация артериальной крови < 90 %.
в– Только у больных с положительным острым вазодилатационным тестом, I для ИЛАГ, IIб для других форм ЛАГ;
г– IIa B при IV функциональном классе по NYHA;
д– эти препараты в настоящее время изучаются в РКИ и класс рекомендаций для них не установлен.
Класс рекомендаций не указан для лекарств, которые в настоящее время только изучаются в РКИ. Также приведены показания для каждого вида лечения, принятые в отдельных странах (табл. 11).
Таблица 11. Показания для различных видов лечения, принятые в отдельных странах
| Вид лечения | Страна | Показания | ||
|---|---|---|---|---|
| Этиология | Функциональный класс по NYHA / ВОЗ | |||
| Пероральные антикоагулянты | - | - | - | |
| Диуретики | - | - | - | |
| Дигоксин | - | - | - | |
| Кислород | - | - | - | |
| Антагонисты кальция | - | - | - | |
| Эпопростенол | Европаа | ИЛАГ | III-IV | |
| США, Канада | ИЛАГ и ЛАГ при ЗСТ | III-IV | ||
| Трепростинил | США | ЛАГ | II-III-IV | |
|
Европейский союз | ИЛАГ | III | |
| Австралия | ИЛАГ, ЛАГ при ЗСТ и ХТЭЛГ | III-IV | ||
| Илопрост (внутривенный) | Новая Зеландия | ЛАГ | III-IV | |
| Берапрост | Япония, Корея | ИЛАГ | II-III-IV | |
| Босентан | Европейский союз | ЛАГб | III | |
| США, Канада | ЛАГ | III-IV | ||
| Ситаксентан | - | - | - | |
| Амбрисентан | - | - | - | |
| Силденафил | - | - | - | |
| Комбинированная терапия | - | - | - | |
| Баллонная предсердная септостомия | - | - | - | |
| Трансплантация легких | - | - | ||
Примечание: ХТЭЛГ – неоперабельная хроническая тромбоэмболическая ЛГ.
а– эпопростенол в Европе не зарегистрирован Европейским Агентством по лекарствам как централизованное лечение, но разрешен в различных европейских странах на местной основе;
б– эффективность доказана при ИЛАГ и ЛАГ при ЗСТ без выраженного интерстициального поражения легких.
Общие мероприятия
Общие мероприятия включают ограничение влияния усугубляющих факторов и внешних воздействий для больных с ЛАГ. Как и в других клинических ситуациях, значение таких мероприятий не исследовалось на научной основе, и рекомендации основаны только на мнении экспертов.
Класс рекомендаций = IIа; уровень доказательности = С.
Физическая активность
Остается неясным, может ли физическая активность оказывать негативное влияние на развитие и прогрессирование ЛАГ. Однако следует избегать появления таких неблагоприятных симптомов, как тяжелая одышка, обмороки и боли в грудной клетке. Для поддержания нормального состояния скелетной мускулатуры физическую нагрузку необходимо ограничить уровнем, не вызывающим никаких патологических проявлений.
Следует избегать физических нагрузок после приема пищи или в условиях экстремальной температуры воздуха. Подбор уровня физической активности может улучшить качество жизни больных и снизить частоту патологических проявлений.
Путешествия / высотные условия
Гипоксия может усилить вазоконстрикцию у больных с ЛАГ, поэтому рекомендуется избегать гипобарической гипоксии, которая начинает появляться на высоте между 1 500 и 2 000 м над уровнем моря.
В салонах пассажирских самолетов условия эквивалентны высоте между 1 600 и 2 500 м, поэтому следует иметь в виду необходимость кислородотерапии во время перелетов у больных с ЛАГ. При планировании путешествии следует собрать информацию о ближайшей к месту назначения клинике, занимающейся лечением ЛГ.
Профилактика инфекций
У больных с ЛАГ высокий риск развития пневмонии, которая в 7 % случаев приводит к летальному исходу. Легочные инфекции у таких больных плохо переносятся и требуют активного распознавания и лечения. Рекомендуется вакцинация против гриппа и против пневмококка. В любом случае длительной лихорадки у больного с внутривенным катетером для постоянного введения эпопростенола следует исключать инфицирование катетера.
Беременность, контроль рождаемости и постменопаузальная терапия
Беременность и роды у больных с ЛАГ связаны с повышенным риском ухудшения состояния и смерти. Несмотря на сообщения в литературе об успешном течении беременности у больных с ИЛАГ, женщинам детородного возраста настоятельно рекомендуются соответствующие методы контроля рождаемости.
Существует соглашение между клиническими руководствами Американской Ассоциации Сердца (American Heart Association) и Американским Колледжем Кардиологов, которые рекомендуют, что беременности следует избегать, а у женщин с цианотическими врожденными пороками сердца, ЛГ и синдромом Эйзенменгера – прерывать. Консенсус экспертов ESC по ведению сердечно-сосудистых заболеваний во время беременности подчеркивает, что тяжелые легочные сосудистые поражения, как давно известно, являются причиной смерти матери в 30-50%.
Однако о наиболее приемлемом методе контроля рождаемости у таких женщин единого соглашения между экспертами нет. Безопасность гормональной контрацепции остается спорной из-за ее протромботического влияния. С другой стороны, существующая сегодня доступность контрацептивов с низкими дозами эстрогенов и одновременная пероральная антикоагулянтная терапия могут снизить риск этих препаратов.
Недавно проведенные исследования с участием большого числа больных не смогли выявить взаимосвязи между использованием гормональных контрацептивов и ЛАГ. Некоторые эксперты высказываются за применение контрацептивов, не содержащих эстрогенов, или хирургическую стерилизацию, или барьерные контрацептивы. Остается неясным, можно рекомендовать гормональную терапию женщинам с ЛАГ в постменопаузальном периоде. Вероятно, это ее можно проводить только в случаях непереносимости менопаузальных симптомов и только вместе с антикоагулянтами.
Уровень гемоглобина
Больные с ЛАГ высокочувствительны к снижению уровня гемоглобина. Любой тип анемии легкой степени следует активно лечить. С другой стороны, больные с длительно существующей гипоксией, например, при шунтировании крови справа налево, склонны к развитию эритроцитоза с повышением гематокрита. При таких обстоятельствах, если у больного с клиническими проявлениями эритроцитоза (головная боль, сниженное внимание) гематокрит выше 65 %, показаны флеботомии (см. раздел по синдрому Эйзенменгера).
Сопутствующие лекарственные препараты
Следует избегать назначения лекарственных препаратов, которые взаимодействуют с пероральными антикоагулянтами или увеличивают риск желудочно-кишечных кровотечений. Даже если нестероидные противовоспалительные препараты, по данным одного случай-контролируемого исследования, по-видимому, не связаны с ЛАГ, их применение у больных с низким сердечным выбросом и преренальной азотемией может снизить клубочковую фильтрацию.
Анорексигены, которые связывали с развитием ЛАГ, теперь изъяты из продажи. Влияние новых поколений анорексигенов на основе серотонина на ЛГ пока неизвестно, но сообщения о связанных с легочной патологией побочных эффектах этих препаратов до настоящего времени отсутствуют.
Эффективность современного лечения бивентрикулярной сердечной недостаточности ингибиторами ангиотензинпревращающего фермента
и бета-блокаторами у больных с ЛАГ не доказана. С другой стороны, эмпирическое назначение этих препаратов, даже в низких дозах, может привести к тяжелым побочным эффектам, таким как гипертензия и правожелудочковая недостаточность и поэтому не рекомендуется.
Психологическая помощь
Средний возраст больных с ЛАГ составляет около 40 лет, и ограничение физической активности значительно меняет их образ жизни. Кроме того, зачастую они получают информацию об их заболевании из различных непрофессиональных источников, которая не всегда достоверна. По этим причинам многие больные ЛАГ страдают от различных тревожных или депрессивных состояний, которые существенно влияют на качество их жизни. В связи с этим очень важна роль экспертов в предоставлении больным адекватной информации и при необходимости направлении к психологу или психиатру.
Для правильного понимания заболевания и отношения к нему больных также полезно создание групп поддержки больных и их семей под руководством психолога или психиатра либо без такового.
Избирательная хирургия
Даже при отсутствии соответствующих исследований предполагается, что избирательная хирургия несет повышенный риск для больных с ЛАГ. Кроме того, риск еще более увеличивается с нарастанием функционального класса по NYHA и в случаях хирургических вмешательств на грудной и брюшной полостях.
Пока не ясно, какой тип анестезии более желателен, но вероятно, эпидуральная анестезия лучше переносится больными, чем общая. Общая анестезия должна проводиться опытными анестезиологами при поддержке экспертов по ЛГ для подбора адекватной терапии в случае возможных осложнений.
Больные, получающие внутривенный эпопростенол или подкожные инъекции трепростинила, имеют меньше проблем, чем пациенты, получающие пероральную или ингаляционную терапию. В последнем случае возможны проблемы с назначением средств для кратковременного наркоза и вспомогательной вентиляцией. Если предполагается длительное (более 12-24 ч) пребывание пациента без лечения, рекомендуется временный перевод на внутривенную терапию с последующим возвращением к первоначальным препаратам.
Лечение антикоагулянтами следует прерывать на возможно меньший период и при этом проводить профилактику тромбоза глубоких вен.
Фармакологичекое лечение
Лечение пероральными антикоагулянтами
Целесообразность применение пероральной антикоагулянтной терапии у больных с ЛАГ объясняется наличием таких традиционных факторов риска венозной тромбоэмболии как сердечная недостаточность и сидячий образ жизни, а также предрасположенностью к тромбоэмболии и тромботическим изменениям в системе легочной микроциркуляции и в эластических легочных артериях.
Подтверждение положительного эффекта пероральной антикоагулянтной терапии у больных с ИЛАГ или ЛАГ, связанной с приемом анорексигенов, получено в ретроспективном анализе одноцентровых исследований. Эти исследования не были рандомизированными и в них были включены только больные ИЛАГ и ЛАГ, связанной с приемом анорексигенов.
Международное нормализационное отношение (МНО) у больных с ИЛАГ варьировало от 1,5 до 2,5 в большинстве клинических центров Северной Америки и от 2,0 до 3,0 в Европейских клинических центрах.
Доказательства необходимости антикоагулянтов у больных с ИЛАГ можно экстраполировать на больных с другими формами ЛАГ при условии тщательной оценки соотношения риска и пользы.
Так, принято считать, что риск желудочно-кишечного кровотечения повышается у больных с ЛАГ, связанной с ЗСТ. Больные с ЛАГ на фоне врожденных пороков сердца с внутрисердечным шунтированием имеют повышенный риск кровохарканья, а также риск парадоксальной легочной эмболии и тромбоза церебральных вен. Больные с порто-пульмональной гипертензией имеют повышенный риск желудочно-кишечных кровотечений за счет варикозного расширения вен и тромбоцитопении. Больные с ЛАГ, получающие постоянную терапию внутривенным эпопростенолом, при отсутствии противопоказаний тоже нуждаются в антикоагулянтах, хотя бы из-за дополнительного риска тромбозов, связанных с постоянным катетером.
В недавно выполненных РКИ пероральные антикоагулянты назначались 51-86 % больных. Интересно, что наибольшая распространенность пероральной антикоагулянтной терапии наблюдалась в исследованиях с участием преимущественно больных с ИЛАГ III и IV функциональных классов по NYHA, а самая низкая – в исследованиях, включавших только больных со склеродермией. Следует обратить внимание на то, что данные о разной эффективности пероральной антикоагулянтной терапии в зависимости от функционального класса или других критериев тяжести отсутствуют.
Для ИЛАГ: класс рекомендаций IIa, уровень доказательности С;
для других форм ЛАГ: класс рекомендаций IIб, уровень доказательности С.
Диуретики
У больных с декомпенсацией правожелудочковой недостаточности возникает задержка жидкости в организме, что ведет к повышению центрального венозного давления, застою в органах брюшной полости, периферическим отекам и затем к асциту. Соответствующая диуретическая терапия у больных с ЛАГ и правожелудочковой недостаточностью дает отчетливый клинический и симптоматический эффект и рекомендуется даже при отсутствии специальных РКИ.
В последних РКИ, посвященных новым методам лечения, 49-70 % больных получали диуретики. Однако недостаток исследований по конкретным классам диуретиков у больных с ЛАГ и индивидуальная вариабельность их эффективности оставляет выбор препарата и дозировок на усмотрение врача. У больных, получающих терапию диуретиками, следует строго контролировать электролиты сыворотки крови и почечную функцию.
Класс рекомендаций I, уровень доказательности С.
Кислород
Большинство больных с ЛАГ (кроме ЛАГ на фоне врожденных пороков сердца) в состоянии покоя могут иметь только легкую степень гипоксемии. Патофизиологические механизмы в этом случае включают низкую сатурацию смешанной венозной крови за счет низкого сердечного выброса и минимальные изменения вентиляционно-перфузионного отношения. У некоторых больных с выраженной гипоксемией может обнаруживаться вторичное открытие овального окна.
У больных с ЛАГ на фоне врожденных пороков сердца гипоксемия связана с шунтированием крови слева направо и, как правило, рефрактерна к терапии ингаляционным кислородом.
В настоящее время отсутствуют достоверные сведения об эффективности длительной кислородотерапии у больных ЛАГ. Хотя у некоторых больных с ЛАГ отмечается улучшение состояния на фоне низкопоточной кислородотерапии, эти результаты не подтверждены в контролируемых исследованиях. Однако, в целом представляется важным поддерживать сатурацию кислорода в любых условиях выше 90 %. Более спорно использование кислорода у больных с ЛАГ на фоне внутрисердечного шунтирования крови. Фактически, в контролируемых исследованиях у больных с синдромом Эйзенменгера кислородотерапия в ночные часы не влияла на гематологические показатели, качество жизни и выживаемость. В любом случае, эффект постоянной терапии кислородом у таких больных невыяснен.
Класс рекомендаций IIa, уровень доказательности С.
Сердечные гликозиды и добутамин
Поскольку при прогрессировании правожелудочковой недостаточности снижение сократительной способности миокарда является одним из основных моментов, для лечения этого состояния показаны инотропные препараты.
Кратковременное внутривенное введение дигоксина больным с ИЛАГ вызывает умеренное повышение сердечного выброса и значительное снижение уровня циркулирующего норадреналина, однако информация об эффективности длительного назначения дигоксина отсутствует. Аналогичным образом использование препаратов дигиталиса у больных с ЛАГ и рефрактерной правожелудочковой недостаточностью основано в первую очередь на опыте врачей, а не на научных доказательствах эффективности. Дигиталис может назначаться в редких случаях у больных с ЛАГ и мерцанием или трепетанием предсердий для урежения частоты желудочковых сокращений. Дигоксин назначался 18-53 % больных, участвовавших в последние РКИ по ЛАГ.
Больные с конечной стадией ЛАГ в большинстве экспертных клинических центров получали внутривенный добутамин. Такое лечение часто приводит к клиническому улучшению различной продолжительности, как при тяжелой левожелудочковой недостаточности.
Класс рекомендаций IIб, уровень доказательности С.
Антагонисты кальция
Гипертрофия медии в мелких легочных артериях наряду со снижением ЛСС после назначения вазодилататоров позволила Паулю Вуду много лет назад разработать гипотезу вазоконстрикции как основу патогенеза и патофизиологии ИЛАГ. Сегодня понятно, что только у небольшой части больных с ИЛАГ традиционные вазодилататоры, такие как антагонисты кальция, могут вызвать клинически значимое снижение ДЛА и связанное с этим стойкое клиническое улучшение.
Положительный клинический и прогностический эффект высоких доз антагонистов кальция у больных с ИЛАГ и положительной реакцией легочных сосудов (описание положительного острого теста на вазореактивность см. в разделе "Диагностика") показан в одноцентровых нерандомизированных неконтролируемых исследованиях. В этих исследованиях группа сравнения была представлена больными без положительной реакции в тесте на вазореактивность, которые сами по себе могли иметь более неблагоприятный прогноз по сравнению с пациентами, ответившими положительно на вазодилататоры.
Однако эта гипотеза не имеет четкого подтверждения, более того, представляется неэтичным прекращать лечение высокими дозами антагонистов кальция больному со стабильным снижением ДЛА, полученным в острой фармакологической пробе, и проводить плацебо-контролируемые исследования у таких больных.
В вышеописанных исследованиях преимущественно использовались нифедипин и дилтиазем, и выбор основывался на исходной ЧСС пациента (при относительной брадикардии выбирали нифедипин, при относительной тахикардии - дилтиазем). Дозы этих препаратов, эффективные в отношении ИЛАГ, были относительно высокими – до 120-240 мг / сут. для нифедипина и 240-720 мг / сут. для дилтиазема.
Рекомендуется у больных с положительным тестом на вазореактивность начинать с низких доз (30 мг нифедипина длительного действия дважды в день или 60 мг дилтиазема 3 раза в день) и осторожно повышать их в течение нескольких недель до максимально переносимого уровня. Факторами, ограничивающими дальнейшее наращивание дозы, обычно становятся системная гипотензия и отеки нижних конечностей. В некоторых случаях побочные эффекты антагонистов кальция можно уменьшить добавлением дигоксина и / или диуретиков. Данные об эффективности, переносимости и эффективных дозах антагонистов кальция новых поколений, таких как амлодипин и фелодипин, отсутствуют.
Как было сказано выше (раздел "Диагностика"), в целом только 10-15 % больных с ИЛАГ положительно отвечают на вазодилататоры и только у половины из них длительное лечение антагонистами кальция дает стабильный клинический и гемодинамический эффект. Принято считать, что только в этих случаях рекомендуется продолжение лечения антагонистами кальция в качестве монотерапии.
У больных с ЛАГ на фоне ЗСТ или врожденных пороков сердца целесообразность проведения острого теста на вазореактивность менее очевидна, чем у больных с ИЛАГ. Однако эксперты полагают, что и в этих случаях нужно исследовать острую реакцию на вазодилататоры и при положительном результате осторожно лечить пероральными антагонистами кальция с тщательным контролем за эффективностью и безопасностью такой терапии.
Положительные результаты длительного назначения высоких доз антагонистов кальция также были получены у детей с ИЛАГ.
Для ИЛАГ: класс рекомендаций I, уровень доказательности С;
для других форм ЛАГ: класс рекомендаций IIб, уровень доказательности С.
Синтетический простациклин и его аналоги
Простациклин вырабатывается в основном эндотелиальными клетками и вызывает мощную вазодилатацию всех сосудов. Также он является наиболее сильным эндогенным ингибитором агрегации тромбоцитов и, по-видимому, обладает как цитопротективными, так и антипролиферативными свойствами.
При ЛАГ нарушается метаболизм простациклина в виде снижения экспрессии простациклинсинтетазы в легочных артериях и метаболитов простациклина в моче. Несмотря на то, что остается неясным, является ли нарушение регуляции метаболизма простациклина причиной или следствием ЛГ, это убедительный повод для терапевтического использования простациклина у больных с ЛАГ.
Первоначально клиническое применение простациклина (эпопростенола) было основано на его вазодилатирующих свойствах, доказанных в кратковременных исследованиях, и этот "острый" эффект часто используется при исследовании реактивности сосудов малого круга кровообращения. С другой стороны, даже при отсутствии положительной реакции в остром тесте с эпопростенолом у больных при длительном ечении может наблюдаться клиническое и гемодинамическое улучшение.
Фактически, длительное внутривенное назначение эпопростенола снижает ЛСС ниже уровня, достигаемого в остром тесте на вазореактивность. Объяснение такого результата основано на ингибирующем влиянии простациклина на рост, ремоделирование и облитерацию сосудов, что облегчает частичное восстановление нарушенных функций легочной микроциркуляции. Однако точный механизм эффектов простациклина при ЛАГ неизвестен и, вероятно, многофакторный. Он может включать
- релаксацию гладкомышечных клеток (острую)
- подавление агрегации тромбоцитов
- нормализацию агрегационных нарушений
- "разбивание" тромбоцитарных агрегатов
- восстановление поврежденных эндотелиальных клеток
- торможение миграции и пролиферации сосудистых клеток, что способствует обратному развитию изменений легочных сосудов, улучшает легочный клиренс ЕТ-1, оказывает прямой инотропный эффект, улучшает потребление кислорода скелетными мышцами и снижает гемодинамическую нагрузку.
Клиническое использование простациклина у больных с ЛАГ расширилось благодаря синтезу стабильных аналогов, обладающих различными фармакокинетическими свойствами, но с качественно сходными фармакодинамическими эффектами. Первоначальный опыт применения простациклина у человека был накоплен при использовании эпопростенола, который представляет собой синтезированную соль простациклина.
Эпопростенол
Эпопростенол является стабильным лиофилизированным препаратом, который растворяется вместе с щелочным буфером (глицином), что позволяет вводить раствор внутривенно. В кровотоке эпопростенол быстро метаболизируется (через 3-5 мин). Препарат сохраняет стабильное состояние при комнатной температуре только около 8 ч, поэтому его необходимо вводить непрерывно с помощью инфузионной помпы (например, помпы CADD®) и постоянного катетера (Хикмана). Эпопростенол поддерживается в охлажденном состоянии с помощью охлаждающей упаковки. Применение подкожных катетеров с резервуаром и чрескожных игл, используемых для интермиттирующей терапии, не рекомендуется.
Эффективность непрерывного внутривенного введения эпопростенола исследовалась в 3 открытых контролируемых клинических исследованиях у больных с ИЛАГ и с ЛАГ на фоне склеродермии и сходных с ней заболеваний; результаты приведены в табл. 12. Эпопростенол улучшал клиническое состояние больных, переносимость физических нагрузок и гемодинамику в обоих клинических ситуациях и является единственным лекарственным препаратом, который, по данным РКИ, улучшает выживаемость больных с ИЛАГ.
Недавно опубликованы результаты лечения эпопростенолом двух больших групп больных с ИЛАН. Они показали, что выживаемость в течение 3 лет составила около 65 % и зависела от исходной тяжести состояния больных, а также от эффектов терапии через 3 мес. Авторы предполагают, что больные, ставшиеся спустя 3 мес. лечения эпопростенолом в III или IV функциональном классе по NYHA или у которых за этот период не было достигнуто значительного улучшения физического и гемодинамического статуса, должны рассматриваться как кандидаты на трансплантацию легких.
Длительное лечение эпопростенолом начинается с дозы 2-4 нг/кг/мин, которая повышается со скоростью, зависящей от развития побочных эффектов (покраснение кожи, головная боль, диарея, боль в ногах). Эффективная доза в первые 2-4 нед. лечения обычно составляет 10-15 нг/кг/мин, в дальнейшем в связи с возможным развитием толерантности к препарату для достижения и сохранения максимального результата требуется периодическое повышение дозы. Оптимальная доза варьирует между 20 и 40 нг/кг/мин, но современная стратегия ее повышения различается в разных клинических центрах. В двух больших группах больных, получавших эпопростенол, средняя доза была соответственно 21 ± 7 и 27 ± 8 нг/кг/мин.
Побочные эффекты при постоянной терапии эпопростенолом встречаются часто и включают
- покраснение кожи
- боль в области челюсти
- диарею
- головную боль
- боль в спине, голенях и стопах
- спазмы в брюшной полости
- тошноту
- иногда гипотензию.
Частота побочных эффектов зависит от скорости повышения дозы.
Снижение дозы необходимо только в случае среднетяжелых или тяжелых побочных эффектов. После нового увеличения дозы побочные эффекты могут возобновиться, но обычно в легкой форме и проходящие самостоятельно через некоторое время без изменения дозы. В некоторых случаях описано развитие асцита, связанного с повышенной проницаемостью брюшины, вызванной эпопростенолом. Более серьезные побочные эффекты связаны с системой доставки лекарства; чаше они связаны с несостоятельностью помпы, местной инфекцией, закупоркой катетера и сепсисом.
В упомянутых выше двух больших группах больных частота сепсиса составила 0,14 и 0,19 эпизодов на 1 пациента в год, и было 8 летальных исходов (2,8 % из 340 пациентов), связанных непосредственно с инфицированием катетера. Местные инфекции могут иметь вид небольшого инфицирования места введения катетера, подкожных либо "туннельных" инфекций. Редко развиваются пневмо- и гемоторакс как осложнения постановки катетера.
Следует избегать резкого прекращения инфузии эпопростенола, так как у некоторых больных это вызывает синдром отмены в виде утяжеления клинической картины ЛГ и даже летального исхода. Ведение больных при длительном лечении эпопростенолом требует соответствующей инфраструктуры, в том числе опытных медицинских сестер и врачей.
Несмотря на то, что РКИ, посвященные лечению эпопростенолом, проводились только у больных с ИЛАГ и ЛАГ на фоне склеродермии, положительные результаты получены в неконтролируемых исследованиях у других подгрупп больных ЛГ: при ИЛАГ у детей, при системной красной волчанке и других ЗСТ, при ЛАГ, связанной с врожденными пороками сердца с системно-легочными шунтами как с хирургической коррекцией, так и без нее, у больных с порто-пульмональной гипертензией, при ЛАГ на фоне болезни Гоше и при ВИЧ-инфекции. Нет единого мнения об эффективности эпопростенола у больных с неоперабельной ХТЭЛГ, хотя некоторые положительные результаты были получены.
В Европейском Союзе эпопростенол не зарегистрирован как обязательное лечение, но разрешен на местной основе в различных европейских странах для больных с ИЛАГ с III и IV функциональным классом по NYHA. Эпопростенол разрешен к применению Комитетом по лекарствам и пищевым продуктам (Food and Drug Administration - FDA) США и Канады для больных с ИЛАГ и ЛАГ, связанной с ЗСД, III и IV функционального класса по NYHA.
Для ИЛАГ и ЛАГ, связанной с ЗСТ: класс рекомендаций I, уровень доказательности А;
для других форм ЛАГ: класс рекомендаций IIа, уровень доказательности С.
Аналоги простациклина исследовались в четырех РКИ, результаты которых приведены в табл. 13.
| Исследование | Трепростинил | Берапрост - Европейский союз | Берпрост - США | Илопрост |
|---|---|---|---|---|
| Число больных | 469 | 130 | 116 | 203 |
| Путь введения | Подкожно | Перорально | Перорально | Ингаляционно |
| Длительность, мес. | 3 | 3 | 12 | 3 |
| Функцинальный класс по NYHA, % | ||||
| II | 11 | 49 | 53 | - |
| III | 82 | 51 | 47 | 59 |
| IV | 7 | - | - | 41 |
| Этиология, %а | ||||
| ИЛАГ | 58 | 48 | 74 | 54 |
| ЗСТ | 19 | 7 | 10 | 17 |
| Врожденные пороки сердца | 24 | 21 | 16 | - |
| ХТЭЛГ | - | - | - | 28 |
| ВИЧ | - | 7 | - | - |
| Порто-пульмональная ЛГ | - | 16 | - | - |
| Эффективность лечения | ||||
| Пиковое VO2, %должн. | Нет данных | Нет данных | Тенденция к повышению | Нет данных |
| Изменения 6МТ, м | 16б | 25 | 31бв | 36 |
| Гемодинамика | Улучшение | Нет изменений | Нет изменений | Улучшениег |
| Клиническое состояние | Улучшение | Нет изменений | Улучшениег | Улучшение |
Примечание:
а– сумма процентов может не составлять 100 %, но округлена до ближайшего числа, 0,5 округлен в сторону большего значения;
б– изменения медианы;
в– статистически достоверны через 3 и 6 мес.;
г– в пре-ингаляционный период улучшилось только ЛСС, а наиболее стабильное улучшение других показателей наблюдалось в пост-ингаляционный период.
Трепростинил
Трепростинил является трициклическим бензидиновым производным эпопростенола с удовлетворительной химической стабильностью, позволяющей вводить его в физиологическом растворе при температуре окружающего воздуха как внутривенно, так и подкожно.
Подкожное введение препарата можно проводить с помощью микроинфузионной помпы (помпа Mini-Med®) и маленьких подкожных катетеров, аналогичных катетерам, используемым для введения инсулина больным диабетом. В этих случаях устраняются проблемы, связанные с постоянным вмешательством в центральную венозную сеть, например, инфекции, и уход за системой намного проще.
Эффективность непрерывного введения трепростинила при ЛАГ исследовалась в самом большом в мире РКИ с участием больных с ЛАГ, получено улучшение толерантности к физическим нагрузкам, гемодинамических показателей и клинического состояния. Наибольшее увеличение переносимости к физическим нагрузкам получено у больных с наиболее тяжелым исходным состоянием и у больных, способных переносить верхний квартиль дозы (> 13,8 нг/кг/мин). В более раннем пилотном контролируемом исследовании трепростинил назначался 26 больным с ЛАГ, при этом выявлена тенденция к увеличению расстояния, пройденного в 6МТ и к снижению ЛСС.
Наиболее частым побочным эффектом препарата является боль в месте введения, что становится причиной прекращения лечения в 8 % случаев и ограничивает повышение дозы еще у части больных. Общая летальность в группе составила 3 %, разницы между группами выявлено не было. Предварительное сообщение показало возможность перевода больных с внутривенного эпопростенола на подкожный трепростинил.
В 2002 г. FDA разрешил использование трепростинила у больных ЛАГ II, III и IV функциональных классов по NYHA.
Для ЛАГ: класс рекомендаций IIa, уровень доказательности В.
Берапрост натрия
Берапрост натрия является первым химически стабильным аналогом простациклина, активным при пероральном приеме. Он быстро всасывается, пиковая концентрация достигается через 30 мин, период полувыведения 35-40 мин после однократного перорального приема.
Активный в пероральной форме аналог простациклина берапрост исследовался у больных с ЛАГ в двух РКИ в Европе и США (см. табл. 13). В 1-м исследовании препарат назначался перорально 4 раза в день в наивысшей переносимой дозе (медиана дозы 80 мкг 4 раза в день) и привел к увеличению переносимости физических нагрузок у больных с ИЛАГ через 3 мес. Во 2-м рандомизированном исследовании, продолжавшемся 12 мес., было получено улучшение переносимости физических нагрузок через 3 и 6 мес., но не позже. Гемодинамических улучшений выявлено не было, и клинические проявления уменьшились только через 6 мес.
Берапрост натрия разрешен в Японии и Южной Корее для больных с ИЛАГ, но его исследования в Европе и США прекращены.
Для ЛАГ: класс рекомендаций IIб, уровень доказательности В.
Ингаляционный илопрост
Илопрост представляет собой химически стабильный аналог простациклина, имеющийся в форме для внутривенного, перорального и ингаляционного введения. Ингаляционная терапия ЛАГ привлекает теоретической возможностью селективного воздействия на легочную микроциркуляцию.
Фактически, поскольку интраацинарные легочные артерии тесно окружены альвеолами, можно дилатировать эти сосуды, доставив лекарство в альвеолы. Важно, чтобы частицы аэрозоля были достаточно мелкими (диаметром 3-5 мкм).
После однократной ингаляции илопроста наблюдалось снижение среднего ДЛА на 10-20 %, которое сохранялось в течение 45-60 мин. Короткая длительность действия требует частых ингаляций (от 6 до 12 раз в день) для получения постоянного эффекта при длительном лечении. При использовании струйных небулайзеров каждая ингаляция занимает около 15 мин, при использовании альтернативных аппаратов, таких как ультразвуковые небулайзеры, длительность ингаляции уменьшается до 5 мин.
Ингаляционный илопрост оценивался в РКИ, в котором ежедневные повторные ингаляции препарата (6-9 раз в день, 2,5-5 мкг на 1 ингаляцию, медиана дозы 30 мкг в день) сравнивали с ингаляциями плацебо у больных с ЛАГ и ХТЭЛГ (см. табл. 13). Исследование показало увеличение переносимости физических нагрузок и клинического состояния, снижение ЛСС только у больных с ИЛАГ. В целом, ингаляционный илопрост переносился хорошо, но кашель, покраснение кожи и головная боль появлялись чаще в группе илопроста.
Также опубликованы результаты долговременного неконтролируемого исследования с участием 25 больных с ИЛАГ, получавших не менее 1 года лечение ингаляционным илопростом в дозе 100-150 мкг / сут.: расстояние, пройденное в 6МТ, увеличилось в среднем на 85 м, среднее ДЛА снизилось на 7 мм рт. ст., сердечный индекс возрос на 0,6 л/мин/м2. В небольшом исследовании 8 больных с ЛГ и легочным фиброзом острое назначение ингаляционного илопроста вызвало выраженную легочную вазодилатацию с сохранением показателей газообмена и системного артериального давления, что показало возможную пользу назначения препарата у этой категории больных.
Лечение ингаляциями илопроста разрешено Европейским Агентством по оценке медицинской продукции в Европе при ИЛАГ III функционального класса по NYHA и в Австралии и Новой Зеландии при ЛАГ и неоперабельной ХТЭЛГ III и IV функциональных классов.
Для ЛАГ: класс рекомендаций IIa, уровень доказательности В.
Внутривенный илопрост
Непрерывное внутривенное введение илопроста в небольших группах больных с ЛАГ и ХТЭЛГ оказалось так же эффективным, как и эпопростенола. Илопрост обладает преимуществом, поскольку более стабилен при комнатной температуре и не требует восстановления и охлаждения.
Непрерывное внутривенное введение илопроста разрешено в Новой Зеландии для больных с ЛАГ III и IV функциональных классов по NYHA.
Для ЛАГ: класс рекомендаций IIa, уровень доказательности С.
Антагонисты рецепторов эндотелина-1 (АЭР)
ЕТ-1, пептид, вырабатываемый преимущественно эндотелиальными клетками сосудов, характеризуется мощным вазоконстрикторным и митогенным воздействием на гладкие мышцы. ЕТ-1 связывается с двумя типами рецепторов: ЕТА и ЕТВ. Рецепторы ЕТА находятся в гладкомышечных клетках, рецепторы ЕТВ – в эндотелиальных и гладкомышечных клетках. Активация рецепторов ЕТА и ЕТВ на гладкомышечных клетках вызывает вазоконстрикторный и митогенный эффекты ЕТ-1. Стимуляция эндотелиальных рецепторов ЕТВ способствует клиренсу ЕТ-1 и высвобождению NO и простациклина.
Активация системы ЕТ-1 продемонстрирована как в плазме, так и в легочной ткани больных с ЛАГ. Хотя не ясно, является ли повышение уровня ЕТ-1 в плазме причиной или следствием ЛГ, исследования системы тканевого ЕТ-1 подтвердили значимую роль ЕТ-1 в патогенезе ЛАГ. Четкое доказательство активации системы ЕТ-1 обусловливает необходимость исследования антагонистов ЕТ-1 у больных ЛАГ.
Наиболее эффективный способ подавления системы ЕТ-1 – применение антагонистов рецепторов ЕТ-1, которые блокируют либо ЕТА, либо ЕТА и ЕТВ.
К настоящему времени проведено 3 РКИ с антагонистами рецепторов ЕТ-1 у больных с ЛАГ (табл. 14):
| Исследование | Пилотное исследование босентана | Основное исследование босентана | Ситаксентан |
|---|---|---|---|
| Число больных | 32 | 213 | 178 |
| Способ введения | Пероральный | Пероральный | Пероральный |
| Длительность, мес. | 3 | 4 | 3 |
| Первичные конечные показатели | 6МТ | 6МТ | Пиковое VO2 |
| Функциональный класс по NYHA (%) | |||
| II | - | - | 33 |
| III | 100 | 91 | 66 |
| IV | - | 9 | 1 |
| Этиология, %а | |||
| ИЛАГ | 85 | 70 | 53 |
| ЗСТ | 15 | 30 | 24 |
| Врожденные пороки сердца | - | - | 24 |
| ВИЧ | - | - | - |
| Эффективность лечения | |||
| Пиковое VO2, %должн. | Нет данных | Нет данных | +3%б |
| Изменения 6МТ, м | +76 | +44 | +34 |
| Гемодинамика | Улучшение | Нет данных | Улучшение |
| Клиническое состояние | Улучшение | Улучшение | Улучшение |
Примечание:
а– сумма процентов может не составлять 100 %, но округлена до ближайшего числа, 0,5 округлен в сторону большего значения;
б– только для дозы 300 мг.
Босентан
Босентан – пероральный антагонист рецепторов ЕТА и ЕТВ и первая молекула этого класса препаратов, которая была синтезирована.
Босентан оценивался при ЛАГ в двух РКИ и привел к улучшению физической толерантности, функционального класса, гемодинамических, эхокардиографических и Д-ЭхоГ показателей и увеличивал время до следующего клинического ухудшения. В более крупном исследовании BREATHE-1 больные были рандомизированы в отношении 1 : 1 : 1 и получали плацебо или 3462,5 мг босентана дважды в день в течение 4 нед., а затем 125 мг босентана дважды в день или 250 мг дважды в день в течение не менее 12 нед.
Хотя все дозировки босентана приводили к значительному клиническому улучшению, по сравнению с плацебо улучшение было более выраженным при дозе 250 мг 2 раза в день, чем при дозе 125 мг 2 раза в день (+54 м и +35 м в 6МТ соответственно).
Однако формально не было установлено зависимости эффективности от дозы. Хотя сходный эффект был получен и у больных с ИЛАГ, и у больных с ЛАГ на фоне склеродермии, босентан увеличил пройденное за 6 мин расстояние только у больных с ИЛАГ (+46 м в группе босентана против -5 м в группе плацебо), в то время как у больных со склеродермией препарат замедлял снижение физической толерантности (+3 м в группе босентана против -40 м в группе плацебо).
Повышение печеночных трансаминаз выявлялось у 10 % больных, этот эффект был дозозависимым и обратимым после снижения дозы или отмены препарата. Фактически, функция печени нарушалась чаще и в более тяжелой степени в группе с дозировкой босентана 250 мг; трансаминазы снижались во всех случаях при уменьшении дозы препарата. На основании этих результатов была определена рекомендуемая эффективная терапевтическая доза босентана 125 мг дважды в день. Наиболее вероятный механизм изменений печеночных ферментов при лечении босентаном состоит в дозозависимом влиянии босентана и его метаболитов на билиарную экскрецию желчных солей, что приводит к задержке желчных солей, которые оказывают цитотоксическое воздействие на гепатоциты.
В другом расширенном исследовании босентан получали 29 больных. К 6-му мес. больные сохранили увеличение расстояния, пройденного в 6МТ, а длительное лечение босентатом (более 1 года) привело к улучшению показателей гемодинамики и функционального класса по NYHA.
Пероральный босентан недавно предложен для эпизодического лечения больных с тяжелыми и / или непереносимыми побочными эффекта от терапии простаноидами, в том числе с сепсисом на фоне внутривенного введения эпопростенола.
Открытое неконтролируемое одноцентровое исследование с множественными дозировками было выполнено у детей 4-17 лет с ЛАГ (BREATHE-3) с целью оценки фармакокинетики, переносимости и безопасности перорального босентана. В этом предварительном исследовании значительное улучшение показателей гемодинамики было получено через 12 нед лечения у 18 детей, получавших босентан в качестве монотерапии либо в комбинации с эпопростенолом.
За счет возможности повышения печеночных трансаминаз FDA требует проводить исследование печеночной функции у больных, получающих босентан, по крайней мере ежемесячно. Европейское Агентство по оценке медицинской продукции также рекомендует ежемесячно мониторировать показатели функции печени.
Кроме того, следует регулярно исследовать гемоглобин и гематокрит, поскольку босентан может вызывать развитие анемии, обычно нетяжелой. Также у больных, принимавших босентан, отмечались задержка жидкости в организме и отеки нижних конечностей.
Особое внимание следует обращать на адекватную контрацепцию у женщин детородного возраста из-за потенциального тератогенного эффекта босентана. Босентан может снижать эффективность гормональных контрацептивов, по этой причине они не должны использоваться в качестве единственного средства. Существует мнение, что класс эндотелиальных антагонистов способен вызывать атрофию яичек и мужское бесплодие.
Босентан разрешен для лечения ЛАГ III и IV функциональных классов по NYHA в США и Канаде.
В Европе он разрешен Европейским Агентством по оценке медицинской продукции для лечения больных с III функциональным классом по NYHA с пояснением, что эффективность препарата была продемонстрирована только для ИЛАГ и ЛАГ, связанной со склеродермией без выраженного легочного фиброза.
Для ИЛАГ III функционального класса по NYHA и ЛАГ, связанной со склеродермией без выраженного легочного фиброза: класс рекомендаций I, уровень доказательности А;
для ИЛАГ IV функционального класса по NYHA и ЛАГ, связанной со склеродермией без выраженного легочного фиброза: класс рекомендаций IIа, уровень доказательности В.
Ситаксентан
Ситаксентан – селективный пероральный антагонист рецепторов ЕТА – оценивался в одном РКИ с участием 178 больных с ЛАГ II, III и IV функциональных классов по NYHA. Этиология ЛАГ в этой группе больных включала ИЛАГ и ЛАГ, связанную с ЗСТ и врожденными пороками сердца. Больные были разделены в рандомизированном порядке в отношении 1 : 1 : 1 на группы, получавшие плацебо, ситаксентан 100 мг и ситаксентан 300 мг перорально один раз в день в течение 12 нед. Получено улучшение в переносимости физических нагрузок, гемодинамических и клинических показателях. Частота изменения функциональных показателей печени, обратимого во всех случаях, составила 0 % при дозе 100 мг / сут. и 9,5 % при дозе 300 мг / сут. Дополнительное пилотное исследование этого же препарата у 20 больных с ЛАГ показало аналогичные результаты.
Ситаксентан может увеличивать МНО или протромбиновое время за счет ингибирования фермента CYP2С9 Р450, основного фермента печени, участвующего в метаболизме варфарина. Это взаимодействие можно регулировать, снижая дозу варфарина до достижения необходимого уровня МНО.
Другое РКИ, изучающее эффективность и побочные эффекты ситаксентана с целью получения разрешения фармакологических комитетов на применение препарата в клинической практике, продолжается в настоящее время. Для ситаксентана не определен класс рекомендаций, поскольку препарат пока доступен только для больных, участвующих в РКИ.
Класс рекомендаций в настоящее время не определен, уровень доказательности В.
Амбрисентан
Амбрисентан является селективным пероральным антагонистом рецепторов ЕТА и изучался в пилотном слепом исследовании со сравнением доз у 64 больных с ЛАГ. Предварительные результаты свидетельствуют об улучшении переносимости физических нагрузок и показателей гемодинамики, сходном с результатами, полученными для других АЭР. В настоящее время проводятся два РКИ с амбрисентаном, оценивающие эффективность и побочные эффекты и имеющие целью получение разрешения фармакологических комитетов на применение препарата в клинической практике.
Класс рекомендаций для амбрисентана также не определен, поскольку препарат пока доступен только для больных, участвующих в РКИ.
Класс рекомендаций в настоящее время не определен, уровень доказательности С.
Ингибиторы фосфофдиэстеразы 5-го типа (ФДЭ-5)
Силденафил
Силденафил – пероральный мощный селективный ингибитор циклического гуанозин-3'-5'-монофосфата (цГМФ) ФДЭ 5-го типа, фармакологический эффект которого связан с повышением внутриклеточной концентрации цГМФ. Увеличение концентрации этого нуклеотида оказывает релаксирующее и антипролиферативное действие на гладкомышечные клетки
сосудов.
ФДЭ-5 находится в большом количестве в малом круге кровообращения, и при хронической ЛГ повышаются экспрессия и активность гена ФДЭ-5. Это позволяет предположить, что силденафил оказывает преимущественное влияние на легочные сосуды.
Множество неконтролируемых исследований сообщают о положительных эффектах перорального ингибитора ФДЭ-5 силденафила при ЛАГ, ХТЭЛГ и ЛГ на фоне легочного фиброза. Препарат в дозе от 25 до 75 мг 3 раза в сутки улучшает сердечно-легочную гемодинамику и переносимость физических нагрузок.
Эти исследования сообщают об относительно небольшом числе побочных эффектов (например, головная боль, заложенность носа, нарушения зрения). Недавно опубликованы результаты РКИ с перекрестным дизайном: силденафил в дозе 25-100 мг 3 раза в день назначался 22 больным с ЛАГ II и III функциональных классов по NYHA и через 6 нед. лечения улучшил их клиническое состояние и переносимость физических нагрузок, которая оценивалась по протоколу Naughton на тредмиле (время нагрузки увеличилось с 475 ± 168 с в конце стадии плацебо до 686 ± 224 с в конце стадии силденфила), и гемодинамику.
На совещании Американского Колледжа торакальных врачей в октябре 2004 г. были представлены результаты крупного РКИ с участием 278 больных с ЛАГ II и III функционального класса по NYHA, которые продемонстрировали среднее увеличение расстояния в 6МТ, что по сравнению с плацебо составило 45 м при лечении 20, 40 и 80 мг силденафила 3 раза в день. Все дозы препарата снижали среднее ДЛА к 12-й нед. лечения примерно на 3-5 мм рт. ст.
Во время написания данного руководства силденафил пока не получил разрешения к использованию у больных ЛАГ ни в одном фармакологическом комитете . В настоящее время вопрос о назначении силденафила может рассматриваться у тех больных с ЛАГ, у которых разрешенные виды терапии неэффективны или не показаны.
Класс рекомендаций I, уровень доказательности А.
Комбинированная терапия легочной гипертензии
Комбинированная терапия представляется многообещающим вариантом лечения из-за возможности воздействия сразу на несколько патофизиологических механизмов ЛАГ. Комбинированная терапия осуществляется одновременным назначением двух или более вариантов лечения или добавлением второго (или третьего) вида терапии к предшествующему лечению в случае его неэффективности. Пока неясно, какой из этих вариантов комбинированной терапии предпочтительнее.
Эффективность и безопасность одновременного назначения босентана и эпопростенола исследована у 33 больных с ЛАГ III и IV функциональных классов по NYHA, рандомизированных для лечения эпопростенолом + плацебо или эпопростенолом + босентан (BREATHE-2). В обеих группах получено улучшение гемодинамики, переносимости физических нагрузок и функционального класса. Результаты выявили тенденцию к более выраженному (хотя и статистически недостоверному) улучшению всех гемодинамических показателей в группе эпопростенола + босентан. Однако в этой группе более часто наблюдались и побочные эффекты по сравнению с монотерапией эпопростенолом.
В настоящее время проводятся или планируются другие РКИ для оценки эффектов добавления силденафила к эпопростенолу. В неконтролируемых исследованиях у больных с ЛАГ, состояние которых ухудшалось несмотря на постоянное лечение непарентеральными простаноидами, добавление босентана или силденафила приводило к улучшению легочной гемодинамики и переносимости физических нагрузок.
Класс рекомендаций IIб, уровень доказательности С.
Инвазивные методы лечения легочной гипертензии
Баллонная предсердная септостомия
В нескольких экспериментальных и клинических наблюдениях высказано предположение, что искусственное создание дефекта межпредсердной перегородки может дать положительный результат при тяжелой ЛГ.
Фактически наличие такого дефекта создаст шунтирование крови справа налево и повысит системный выброс, несмотря на снижение при этом системной сатурации артериальной крови и увеличение системного транспорта кислорода. Более того, предсердный шунт разгрузит правое предсердие и правый желудочек (создаст их декомпрессию) и тем самым облегчит клинические проявления правожелудочковой недостаточности
Роль баллонной предсердной септостомии в лечении ЛАГ недостаточно ясна, поскольку эффективность такого вмешательства показана только в одной небольшой группе больных и в описаниях отдельных случаев, всего примерно 120 опубликованных случаев. В большинстве ситуаций это вмешательство проводится у тяжелых больных как паллиативная мера при ожидании трансплантации легких, что объясняет связанную с этой процедурой высокую летальность - от 5 до 15 %.
Кроме симптоматического и гемодинамического улучшения, было показано увеличение выживаемости по сравнению с историческим контролем. В настоящее время баллонная предсердная септостомия показана больным с далекозашедшим функциональным классом III и функциональным классом IV по NYHA с рецидивирующими синкопальными состояниями и / или правожелудочковой недостаточностью несмотря на все доступные лечебные мероприятия.
Септостомия используется либо как паллиативная мера при ожидании трансплантации легких, либо как самостоятельное лечение, когда проведение другого лечения невозможно. Баллонная предсердная септостомия должна проводиться только в клинических центрах, имеющих опыт таких операций для снижения связанного с ней риска.
Класс рекомендаций IIа, уровень доказательности С.
Трансплантация легких
Трансплантация легких или комплекса "сердце-легкие" при ЛАГ оценивалась только в одном проспективном неконтролируемом исследовании, поскольку формально считается неэтичным проводить РКИ при отсутствии альтернативного лечения.
После трансплантации легких и комплекса "сердце-легкие" 3- и 5-летняя выживаемость составляет примерно 55 и 45 % соответственно. При ИЛАГ выполнялись трансплантации как одного, так и обоих легких, и эти операции комбинировали с устранением пороков сердца при синдроме Эйзенменгера. Выживаемость реципиентов после моно- и билатеральной трансплантации легких по поводу ЛАГ примерно одинакова, и в большинстве случаев ЛАГ оба этих варианта равнозначны. Однако многие центры трансплантологии в настоящее время предпочитают проводить билатеральную трансплантацию легких, в частности, из-за меньшей частоты послеоперационных осложнений.
У больных с синдромом Эйзенменгера и при терминальной стадии сердечной недостаточности следует рассмотреть возможность трансплантации легких и сердца, которая при некоторых сложных пороках и дефектах межжелудочковой перегородки дает лучшую выживаемость.
Трансплантация легких и комплекса "сердце-легкие" показана больным с ЛАГ с далекозашедшим функциональным классом III и классом IV по NYHA при рефрактерности клинических симптомов к доступным методам лечения. Непредсказуемая длительность периода ожидания и нехватка донорских органов осложняют принятие решения об оптимальном времени постановки на очередь для трансплантации.
Класс рекомендаций I, уровень доказательности С.
Алгоритм лечения
Алгоритм лечения, разработанный на основе классов рекомендаций и уровней доказательности результатов клинических исследований, представлен на следующем рисунке:
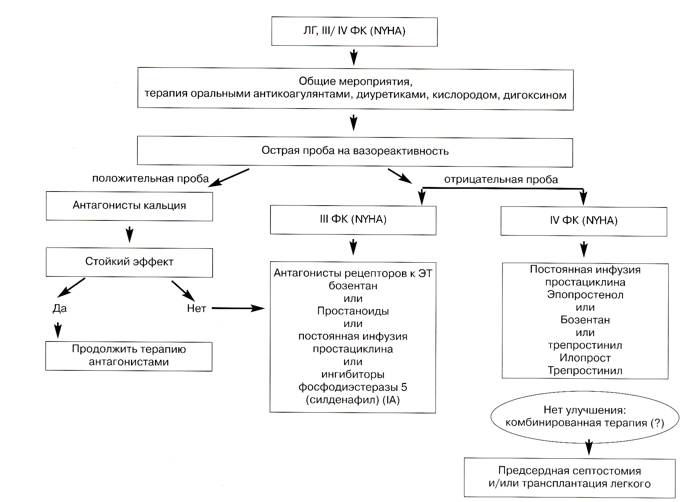
Алгоритм ограничен только больными III и IV функциональных классов по NYHA, поскольку они составляют большинство популяции, участвовавшей в РКИ. Для больных с I и II функциональными классами по NYHA имеются очень скудные данные, и требуются специальные исследования для выработки соответствующей стратегии. В настоящее время больные с I и II функциональными классами по NYHA должны получать фоновую терапию, а при положительной реакции на вазодилататоры - антагонисты кальция.
При наличии нескольких показателей благоприятного прогноза (см. раздел "Оценка тяжести") рекомендуется тщательное наблюдение или включение больного в РКИ.
Различные методы лечения изучались в основном у больных с ИЛАГ, ЛАГ на фоне склеродермии или приема анорексигенов, и следует осторожно экстраполировать эти рекомендации на другие виды ЛАГ (см. раздел "Особые состояния").
После установления диагноза ЛАГ предпочтительный первоначальный подход состоит в общих мероприятиях и фоновой терапии, которая включает пероральные антикоагулянты (при отсутствии противопоказаний), диуретики при задержке жидкости, иналяционный кислород при гипоксемии и дигоксин при рефрактерной правожелудочковой недостаточности и / или суправентрикулярной аритмии.
В связи со сложностью дополнительного обследования и доступных вариантов лечения настоятельно рекомендуется направлять больных с ЛАГ в специализированные клинические центры.
Острый тест на вазореактивность должен проводиться всем больным с ЛАГ, хотя чаще всего тест бывает положительным у больных с ИЛАГ и ЛАГ, связанной с приемом анорексигенов, которые хорошо отвечают на высокие дозы антагонистов кальция. Больные с положительным тестом на вазореактивность, как говорилось выше, должны получать оптимально переносимые дозы антагонистов кальция. Стабильность положительного эффекта от лечения следует оценивать спустя 3-6 мес. от начала терапии антагонистами кальция (сохранение функционального класса I или II по NYHA с почти нормальной гемодинамикой).
Больные с отрицательным тестом на вазореактивность, имеющие функциональный класс I или II по NYHA, должны продолжить фоновую терапию при тщательном клиническом наблюдении.
Больные с отрицательным тестом на вазореактивность или с положительным тестом, остающиеся в III функциональном классе по NYHA, должны рассматриваться как кандидаты на лечение либо АЭР, либо простаноидами. В настоящее время единственным имеющимся в продаже и разрешенным к использованию АЭР является пероральный антагонист обоих эндотелиновых рецепторов-босентан. Среди порстаноидов трепростинил назначается подкожно и разрешен в США; илопрост, используемый в виде аэрозоля, разрешен в Европе и Австралии, берапрост разрешен в Японии и Южной Корее. Непрерывное внутривенное введение эпопростенола также может назначаться при III функциональном классе по NYHA и рефрактерности к АЭР или другим простаноидам.
Некоторые авторы по-прежнему считают эпопростенод препаратом выбора у больных с III функциональным классом по NYHA из-за его положительного влияния на выживаемость.
Выбор конкретного препарата зависит от различных факторов, в том числе разрешения на использование препаратов, способа введения, побочных эффектов, предпочтений больного и опыта врача.
Пероральный ингибитор ФДЭ-5 силденафил в настоящее время не разрешен для лечения ЛАГ ни одним из фармакологических комитетов, и его применение возможно только у больных, у которых разрешенные виды терапии неэффективны или противопоказаны. После завершения основного РКИ и оценки его результатов фармакологическими комитетами роль этого препарата будет более ясна.
Непрерывное внутривенное введение эпопростенола, разрешенного в США и Европе, может рассматриваться как лечение первого ряда при ИЛАГ у больных с IV функциональным классом по NYHA из-за положительного влияния на выживаемость в этой категории больных. Хотя босентан и трепростинил показаны больным с IV функциональным классом, в клинические исследования этих препаратов было включено очень немного таких больных. Соответственно, большинство экспертов расценивают это лечение как терапию второго ряда для тяжелых больных. Не проведено ни одного РКИ с внутривенным илопростом, но тем не менее этот аналог простациклина разрешен в Новой Зеландии.
Комбинированная терапия (например, АЭР + простаноиды) может назначаться больным при отсутствии улучшения или ухудшения состояния на фоне лечения препаратами первого ряда несмотря на то, что данные об этом особом способе лечения ограничены и представлены в основном неконтролируемыми исследованиями. Необходимо разработать соответствующие протоколы по времени и дозировкам для уменьшения возможных побочных эффектов комбинированной терапии.
Баллонная предсердная септостомия и / или трансплантация легких показаны при рефрактерной ЛАГ или при невозможности проведения медикаментозного лечения. Эти процедуры должны выполняться только в клинических центрах, имеющих подобный опыт.
Особые состояния
Легочная артериальная гипертензия в детском возрасте
Частота
Врожденные пороки сердца чаще встречаются у детей, чем у взрослых, и необходимо вовремя распознать эту важную причину ЛАГ. Напротив, ЛАГ, связанная с ЗСТ, портальной гипертензией, ВИЧ-инфекцией и воздействием лекарств и токсинов, у детей встречается реже.
К ЛАГ также относится персистирующая легочная гипертензия новорожденных (ПЛГН), хотя ее патогенез и лечение существенно отличаются от других форм ЛАГ и поэтому не обсуждается в данном руководстве. ПЛГН обычно преходящая с полным выздоровлением, не требующим постоянной поддерживающей терапии, либо летальным исходом в неонатальном периоде, несмотря на максимальный объем кардиопульмональных терапевтических мероприятий.
Патогенез
Механизм развития ЛАГ у детей и взрослых не имеет четких различий. Однако ПЛГН может иметь некоторые специфические механизмы за счет наличия особенностей легочной сосудистой системы плода и незаращения овального окна. Кроме того, положительный острый тест на вазореактивность чаще наблюдается у детей с ИЛАГ, что позволяет думать, что вазоконстрикция может приводить к необратимым обструктивным изменениям сосудов у этой категории больных.
Клиническая картина и обследование
Клинические, диагностические и прогностические данные по ЛАГ в основном собраны для взрослой популяции, поэтому часто необходимо экстраполировать эти данные на педиатрический контингент.
По данным Регистра Национального Института здоровья при отсутствии лечения ЛАГ летальность выше среди детей, чем среди взрослых. Однако эти данные получены на небольшом числе педиатрических случаев до того, как многие современные методы лечения стали доступными. Теоретически, следует ожидать, что ответ на терапию у детей должен быть лучше из-за того, что сосуды продолжают меняться по мере роста ребенка. Новые методы лечения достигли лучших результатов у детей, чем у взрослых с ЛАГ, но у детей течение болезни менее предсказуемо. Остается неясным, почему течение одинаковых форм ЛАГ у разных детей может различаться.
Несмотря на тот факт, что диагностическая стратегия у детей с ЛАГ была исследована только в одном клиническом центре, дети с тяжелой ЛАГ проходят такое же обследование, как и взрослые (см. выше). Эти исследования включают газовый анализ артериальной крови, сатурацию кислорода, рентгенограмму органов грудной клетки, легочные функциональные и нагрузочные тесты, эхокардиографию, вентиляционно-перфузионное сканирование легких, серологические исследования для исключения ЗСТ, исследования свертываемости крови, анализы на ВИЧ.
Диагноз ЛАГ должен быть подтвержден при катетеризации правых отделов сердца. Как и у взрослых с тяжелой ЛАГ, исследование легочной вазореактивности при катетеризации правых отделов сердца включает оценку острого ответа на короткодействующий вазодилататор, такой как ингаляционный NO, внутривенный эпопростенол или внутривенный аденозин, с целью определения возможности длительной терапии антагонистами кальция. Положительная реакция на вазодилататоры чаще встречается у детей, чем у взрослых, и это позволяет детям чаще, чем взрослым, успешно лечиться антагонистами кальция.
Лечение
Терапевтический алгоритм для детей с ЛАГ аналогичен таковому для взрослых, однако имеет несколько специфических особенностей. Например, у детей с положительным ответом на специфическое лечение эффект часто гораздо более выражен, чем у взрослых. И наоборот, при неэффективности такой терапии выживаемость у детей часто более короткая, чем у взрослых с тяжелой формой заболевания.
Поскольку реактивность легочных сосудов у детей с ЛАГ часто выше, чем у взрослых, любая инфекция респираторного тракта, вызывающая нарушение вентиляционно-перфузионного отношения за счет альвеолярной гипоксии, может при отсутствии активного лечения привести к катастрофическим последствиям.
Мы рекомендуем госпитализировать таких детей с пневмонией для проведения антибактериальной терапии и назначать антипиретики при повышении температуры тела более 380С для минимизации последствий повышенных метаболических потребностей.
Требуют уточнения эффективность и безопасность длительной антикоагулянтной терапии у детей с ЛАГ и ее оптимальные схемы. Однако существующее сегодня мнение экспертов заключается в том, что антикоагулянтная терапия необходима у детей с правожелудочковой недостаточностью.
Безопасность и эффективность антагонистов кальция основана на результатах острого вазодилатационного теста; эффективность этих препаратов у детей такая же, как у взрослых. Оптимальные дозы, как правило, относительно высокие, как и у взрослых (см. выше), и дети нуждаются в более высоких дозах на 1 кг веса, чем взрослые, и хорошо переносят их.
Клинические показания для длительной внутривенной терапии эпопростенолом у детей те же, что и у взрослых. Оптимальные дозы эпопростенола как для детей, так и для взрослых пока не уточнены. У детей начальная доза составляет 2 нг/кг/мин, как и у взрослых, и при необходимости повышается. Обычно повышение дозы проводится достаточно быстро в первые месяцы от начала лечения. Хотя средняя доза за год у взрослого больного ЛАГ примерно 20-40 нг/кг/мин, для детей, особенно младшего возраста, она приближается к 50-80 нг/кг/мин, и оптимальная доза значительно варьирует у разных пациентов.
Пероральный берапрост, ингаляционный илопрост и подкожные инфузии трепростинила также применяются в лечении детей с ЛАГ с разной степенью успеха. На практике у детей младшего возраста достаточно трудно подобрать эффективную дозу ингаляционного илопроста даже при хорошей кооперации с пациентом, а подкожные введения трепростинила болезненны. Опыт показывает, что, как и для внутривенного эпопростенола, детям необходимы более высокие дозы на килограмм веса, чем взрослым. Для оценки фармакокинетики, переносимости и безопасности перорального берапроста у детей 4 – 17 лет с ЛАГ было проведено открытое неконтролируемое исследование (BREATHE-3). В этом предварительном исследовании у 18 включенных в исследование детей было получено значительное улучшение показателей гемодинамики через 12 нед лечения пероральным бозентаном как в качестве монотерапии, так и в комбинации с внутривенным эпопростенолом.
Описано применение у детей ингибиторов ФДЭ-5, таких как силденафил, но данные ограничены из-за небольшого числа случаев.
Легочная артериальная гипертензия, связанная с синдромом Эйзенменгера
Патогенез
Синдром Эйзенменгера описан как врожденный порок сердца, вызывающий значительный сброс крови слева направо, который становится причиной тяжелого поражения легочных сосудов и ЛАГ с последующим изменением направления шунтирования. Если первоначально кровь шунтируется слева направо, то затем возросший поток крови, а также повышенное давление приводят к обструкции легочных сосудов, и когда ЛСС приближается или превышает системное сопротивление, направление шунтирования крови меняется.
Клиническая картина и обследование
У большинства больных ухудшается переносимость физической нагрузки и появляется одышка при нагрузке, но эти симптомы могут хорошо компенсироваться в течение многих лет. Могут развиться легочное кровохарканье и кровотечение в результате разрыва дилатированных бронхиальных артерий. Поскольку у больных со сниженной сатурацией артериальной крови нарушается гемостаз, они имеют повышенный риск как кровотечений, так и тромбозов. В результате парадоксальной эмболизации, венозного тромбоза церебральных сосудов или интракраниального кровотечения могут развиться цереброваскулярные осложнения. Кроме того, больные с таким
состоянием имеют высокий риск развития абсцессов головного мозга.
У больных с синдромом Эйзенменгера возможно возникновение синкопальных состояний за счет неадекватного сердечного выброса или, реже, аритмии. Симптомы сердечной недостаточности, которые редко появляются до тех пор, пока болезнь не войдет в развернутую стадию, означают неблагоприятный прогноз.
Выживаемость больных с синдромом Эйзенменгера лучше, чем пациентов с ИЛАГ или АЛАГ со сравнимым функциональным классом. В группе из 100 больных, состоявших в листе ожидания трансплантации легких, актуарная выживаемость больных, не получивших трансплантата, была 97 % через 1 год, 89 % через 2 года и 77 % через 3 года для больных с синдромом Эйзенменгера и 77, 69 и 35 % соответственно для больных с ИЛАГ.
Лечение
Рекомендации по лечению больных с синдромом Эйзенменгера основаны главным образом на клиническом опыте экспертов, а не на специальных РКИ. Больным с среднетяжелыми и тяжелыми признаками повышенной вязкости крови (т. е. головной болью, плохой концентрацией внимания), которая обычно также проявляется увеличением гематокрита > 65 %, следует выполнять флеботомию с изоволюмическим замещением объема крови.
Флеботомию не рекомендуется проводить больным без клинических проявлений или при легкой выраженности симптомов повышенной вязкости крови независимо от уровня гематокрита. Симптомы обычно уменьшаются после удаления одной дозы крови и эквивалентного восполнения объема декстрозой или физиологическим раствором. Флеботомию проводят не более чем 2-3 раза в год во избежание истощения запасов железа в организме и выработки эритроцитов с низким содержанием железа, что повышает вязкость крови.
При появлении признаков правожелудочковой недостаточности назначают диуретики.
Применение кислородотерапии спорно и рекомендуется только в случаях, когда кислородотерапия дает стабильное повышение сатурации артериальной крови и / или улучшает клиническое состояние (легочный рестриктивный компонент). В некоторых клинических центрах больные с синдромом Эйзенменгера при отсутствии противопоказаний получают антикоагулянтную терапию, как при других формах ЛАГ. Другие авторы предлагают избегать назначения антикоагулянтов, которые могут вызвать обострение геморрагического диатеза.
К сожалению, очень мало РКИ, оценивавших эффективность новых лечебных режимов при ЛАГ, включали больных с синдромом Эйзенменгера. Одна из причин этого заключается в том, что в большинстве случаев синдром Эйзенменгера при отсутствии лечения прогрессирует очень медленно, что затрудняет оценку результатов РКИ. Хотя течение ИЛАГ и ЛАГ, связанной с врожденными пороками сердца, значительно отличается от синдрома Эйзенменгера, гистопатологическое сходство этих заболеваний позволяет считать, что при синдроме Эйзенменгера может быть эффективным такой же подход к лечению, как и при этих формах ЛАГ. Однако формально новые методы терапии должны быть исследованы у больных с синдромом Эйзенменгера для оценки соотношения риска и пользы.
Внутривенный эпопростенол оказывает благоприятное воздействие на гемодинамику и физическую толерантность; эффект подкожного трепростинила у больных с синдромом Эйзенменгера не отличался от такового у больных и ИЛАГ. В настоящее время проводится РКИ, оценивающее эффективность бозентана у 65 больных с синдромом Эйзенменгера (BREATHE-5).
Трансплантация легких с коррекцией порока сердца или трансплантация комплекса "сердце-легкие" представляет собой вариант лечения синдрома Эйзенменгера с неблагоприятным прогнозом (синкопальные состояния, рефрактерная к лечению правожелудочковая недостаточность, функциональный класс III или IV по NYHA или тяжелая гипоксемия). Из-за различных факторов, ограничивающих положительный результат трансплантации, и хорошей выживаемости больных на фоне медикаментозной терапии необходим тщательный отбор больных для этого метода лечения.
Порто-пульмональная гипертензия
Частота
ЛАГ является хорошо известным осложнением хронических заболеваний печени. Главным определяющим фактором в развитии ЛГ в большей степени является портальная гипертензия, а не патология печени, как таковая. Описанная впервые в 1951 г. Mantz и Craige, порто-пульмональная гипертензия встречается нечасто, поэтому долгое время дискутировался вопрос, является это сочетание заболеваний случайным или причинно-обусловленым.
Получены доказательства, что развитие ЛАГ у больных с портальной гипертензией не является случайным. В самом деле, частота ЛАГ у больных с портальной гипертензией намного выше, чем установленная частота ИЛАГ в популяции в целом. Большое ретроспективное исследований аутопсий показало, что ЛАГ возникает в 0,13 % общего числа представленных на аутопсию больных против 0,73 % больных с циррозом печени и портальной гипертензией.
Два проспективных исследования гемодинамики показали, что у 2 % больных с циррозом и портальной гипертензией имеется значительная ЛАГ. Два недавно проведенных исследования у больных, перенесших трансплантацию печени, выявили ЛГ в 4 и 3,5 % случаев соответственно. Наконец, исследование IPPHS подтвердило, что цирроз печени является фактором риска развития ЛАГ.
Портальная гипертензия – нередкая причина ЛАГ, больные с порто-пульмональной гипертензией оставляют 8 % всех случаев ЛАГ в Регистре Национального Института здоровья. Вероятность развития ЛГ у больных с портальной гипертензией повышается при хирургических порто-системных шунтах, поскольку, согласно результатам ретроспективного исследования, приблизительно у 65 % больных с ЛАГ выполнялось хирургическое шунтирование, а у 35 % - нет. Эти данные четко показывают, что ЛАГ у больных с портальной гипертензией связана с развитием порто-системных шунтов в большей степени, чем с портальной гипертензией самой по себе.
На риск развития ЛАГ не влияют наличие хронических паренхиматозных заболеваний печени и их тяжесть, так как это осложнение может появиться и у больных с внепеченочной портальной гипертензией. Аналогично, степень портальной гипертензии, установленная по градиенту венозного давления в печеночных венах и изменениям системной гемодинамики, не связана с развитием ЛАГ.
На риск развития ЛАГ может влиять только длительность существования портальной гипертензии.
Патогенез
Механизм, благодаря которому портальная гипертензия способствует развитию ЛАГ, остается неясным. Наличие порто-системных шунтов может способствовать тому, что вазоконстрикторные и вазопролиферативные вещества, в норме выводимые из организма печенью, попадают в легочную циркуляцию.
Серотонин, продуцируемый энтерохромафинными клетками тонкого кишечника, может быть одним из таких веществ. Гистопатологические данные при порто-пульмональной гипертензии неотличимы от таковых, обычно наблюдаемых при ИЛАГ.
Клиническая картина и обследование
Клиническая картина у больных с порто-пульмональной гипертензией может не отличаться от проявлений ИЛАГ или может включать симптомы лежащей в ее основе патологии печени.
Эхокардиографический скрининг для выявления ЛГ у больных с патологией печени возможен при наличии соответствующих симптомов и / или у кандидатов на трансплантацию печени. Во всех случаях повышения сДЛА следует выполнять катетеризацию правых отделов сердца для уточнения гемодинамических нарушений и определения прогностических и терапевтических характеристик.
С точки зрения нарушений гемодинамики, по сравнению с больными с ИЛАГ пациенты с порто-пульмональной гипертензией имеют значительно больший сердечный выброс и существенно более низкое системное сосудистое сопротивление и ЛСС.
Диагноз портальной гипертензии подтверждается при катетеризации правых отделов сердца с помощью катетера Сван-Ганса, если градиент между свободным печеночным венозным давлением и давлением заклинивания (венозный печеночный градиент давления) превышает 10 мм рт. ст. (в норме он менее 5 мм рт. ст.).
В ретроспективном исследовании больные с порто-пульмональной гипертензией имели лучшую выживаемость, чем больные с ЛАГ, хотя это вопрос спорный.
Лечение
Лечение порто-пульмональной гипертензии недостаточно изучено.
Кислородотерапия назначается по потребности для поддержания сатурации артериальной крови > 90 %. Диуретики используются для устранения перегрузки объемом, отеков и асцита. Антикоагулянтная терапия не очень хорошо исследована в этой популяции больных, ее следует избегать при снижении печеночной функции и тромбоцитопении, а также у больных с риском кровотечений за счет варикозного расширения вен пищевода.
При отсутствии заметного увеличения сердечного выброса и относительно низком ЛСС у больных с легкой и среднетяжелой ЛГ следует исследовать реактивность легочных сосудов путем катетеризации. При значительном положительном ответе на вазодилататор возможно осторожное назначение антагонистов кальция. Бета-блокаторы, обычно применяемые в лечении портальной гипертензии и снижающие риск варикозных кровотечений, могут плохо переноситься в случаях ассоциированной ЛАГ из-за отрицательного инотропного влияния на миокард правого желудочка.
В литературе имеется описание множества отдельных клинических случаев и небольших исследований с использованием внутривенного эпопростенола в лечении порто-пульмональной гипертензии. Видимо, больные с порто-пульмональной гипертензией отвечают на длительную терапию внутривенным эпопростенолом аналогично больным с ИЛАГ. Однако описана повышенная частота асцитов и спленомегалии на фоне такого лечения.
Выраженная ЛАГ может значительно повышать риск, связанный с трансплантацией печени, которая противопоказана при среднем ДЛА > 35 мм рт. ст. и / или ЛСС > 250 дин/с/см. В пограничных случаях возможно снизить среднее ДЛА и ЛСС для проведения трансплантации, хотя агрессивное лечение ЛАГ при этом требует применения эпопростенола. В тяжелых случаях, требующих мультиорганной трансплантации, например комбинированной пересадки печени и сердца (легких), риск очень высокий.
У некоторых больных после трансплантации печени ЛАГ уменьшается, в частности, у больных с относительно высоким сердечным выбросом до трансплантации, который после успешной трансплантации снижается. В других случаях ЛАГ после трансплантации может утяжелиться. Иногда это связано с отменой после трансплантации внутривенного эпопростенола. Это следует делать очень постепенно при тщательном наблюдении за больным. Из-за потенциальной гепатотоксичности большинство экспертов не рекомендуют в таких ситуациях применять пероральные АЭР, например босентан. Несмотря на серии случаев его применения с хорошим результатом в экспертных клинических центрах, соотношение риска и пользы при применении АЭР у больных с патологией печени требует тщательного анализа на долговременной основе.
Легочная артериальная гипертензия, связанная с ВИЧ-инфекцией
Частота
ЛАГ является редким, но хорошо изученным осложнением ВИЧ-инфекции; в литературе описано более 200 случаев. Такие неинфекционные сердечно-сосудистые проявления ВИЧ-инфекции, как дилатационная кардиомиопатия, перикардиальный выпот, небактериальный тромботический эндокардит, ранний атеросклероз и ЛАГ стали в последние годы выявляться чаще в связи с увеличением выживаемости и лучшей профилактики оппортунистических инфекций.
В большом случай-контролируемом исследовании 3 349 ВИЧ-инфицированных больных за 5,5 лет наблюдения продемонстрирована кумулятивная частота ЛАГ 0,57 %, что составило 0,1 % в год.
Патогенез
Механизм развития ЛАГ при ВИЧ-инфекции, неизвестен. Предполагается непрямое влияние ВИЧ через цитокины, ростовые факторы или ЕТ-1 в связи с отсутствием вирусной ДНК в клетках легочного эндотелия. Этой гипотезе соответствует наличие периваскулярных воспалительных клеток при ВИЧ-ассоциированной ЛАГ. Кроме того, нельзя не учитывать генетическую предрасположенность, потому что это осложнение развивается только у меньшей части ВИЧ-инфицированных больных. Отсутствие мутаций BMPR2 в группе из 20 больных и ВИЧ-ассоциированной ЛАГ позволяет предположить вовлечение других факторов.
Клиническая картина и обследование
Связанная с ВИЧ-инфекцией ЛАГ имеет такие же клинические, гемодинамические и гистологические характеристики, как ИЛАГ, и не зависит ни от способа передачи ВИЧ, ни от степени иммуносупрессии. Больные с ВИЧ могут одновременно быть инфицированы вирусами гепатитов В и С и иметь сопутствующую патологию печени.
Эхокардиографическое обследование для выявления ЛГ у больных с ВИЧ-инфекцией требуется только при соответствующей симптоматике. При этом необходимо тщательное исключение других причин ЛГ, таких как патология левых отделов сердца, паренхиматозные заболевания легких и печени.
Катетеризация правых отделов сердца рекомендуется во всех случаях при подозрении на ЛАГ, связанную с ВИЧ-инфекцией, для подтверждения диагноза, установления тяжести и исключения патологии левых отделов сердца.
Летальность среди больных с ВИЧ-ассоциированной ЛАГ гораздо больше зависит от самой ЛАГ, чем от других осложнений ВИЧ-инфекции. ЛАГ является независимым прогностическим фактором летального исхода у этих больных.
Лечение
При ВИЧ-ассоциированной ЛАГ терапевтические подходы менее изучены, чем при других формах ЛАГ. Пероральные антикоагулянты часто противопоказаны из-за тромбоцитопении, трудностей сотрудничества с больным и потенциального взаимодействия варфарина с препаратами для лечения ВИЧ-инфекции.
Острый тест на вазореактивность и долговременный эффект от антагонистов кальция в этой группе больных не описаны.
Одно неконтролируемое открытое исследование с участием 6 больных с тяжелой ВИЧ-ассоциированной ЛАГ показало, что непрерывное введение эпопростенола может эффективно улучшить функциональный статус и гемодинамику на срок до 12-47 мес. Пересадка легких у этой категории больных нежелательна.
Роль высокоактивной антиретровирусной терапии в ведении ВИЧ-ассоциированной ЛАГ пока не установлена. Положительное влияние на легочную гемодинамику наблюдалось у больных, получавших нуклеозидные ингибиторы обратной транскриптазы. Недавно описан единственный случай долговременного улучшения гемодинамики на фоне такого лечения без одновременного применения других вазодилатирующих препаратов.
Наконец, в большом моноцентровом исследовании с участием 82 больных однофакторный анализ показал, что число CD4 (> 212 клеток в 1 мм3), комбинированная антиретровирусная терапия и использование эпопростенола улучшали выживаемость. При многофакторном анализе только число CD4-лимфоцитов было независимым прогностическим фактором выживаемости, в основном из-за того, что в изучаемой группе больных комбинированная антиретровирусная терапия и эпопростенол были тесно связаны.
Недавно были получены положительные клинические и гемодинамические результаты при использовании босентана у 16 больных с ЛАГ, связанной с ВИЧ-инфекцией.
Резюмируя вышеизложенное, неконтролируемые исследования показали, что у больных с тяжелой ЛАГ, связанной с ВИЧ-инфекцией, комбинированная антиретровирусная терапия, эпопростенол и, возможно, босентан, могут давать положительный эффект. Однако эффективность эпопростенола, как и АЭР и ингибиторов ФДЭ 5-го типа, должна быть оценена у этой категории больных в РКИ.
Легочная артериальная гипертензия, связанная с заболеваниями соединительной ткани
Частота
Легочная гипертензия является хорошо изученным осложнением заболеваний соединительной ткани, таких как системная склеродермия, системная красная волчанка, смешанные ЗСТ и, в меньшей степени, ревматоидный артрит, дерматополимиозит и первичный синдром Шегрена. У этих больных ЛАГ может развиваться в сочетании с интерстициальным фиброзом или в результате прямого пролиферативного поражения сосудов при отсутствии значительного паренхиматозного поражения или хронической гипоксии. Кроме того, может иметь место легочная венозная гипертензия за счет поражения левых отделов сердца. Очень важно установить механизм, вовлеченный в развитие ЛАГ, так как лечение в каждом случае может существенно различаться.
Трудно установить распространенность ЛАГ у больных с ЗСТ из-за отсутствия четких эпидемиологических данных. Имеющиеся данные очень варьируют в зависимости от определения ЛАГ, метода, используемого для измерения ДЛА и различий в обследуемых популяциях.
Системная склеродермия, особенно в ее ограниченном варианте, который ранее назывался КРЕСТ-синдромом (CREST - кальциноз, болезнь Рейно, нарушение моторики пищевода, склеродактилия и телеангиоэктазия), является основным ЗСТ, связанным с ЛАГ. Недавно законченное в Великобритании исследование регистра Национального института здоровья, куда вошли 722 больных с системной склеродермией, выявило распространенность около 12 %. В другом исследовании 930 больных с системной склеродермией кумулятивная частота ЛГ была 13 %. Однако при использовании популяционного подхода распространенность ЛГ среди 3 778 больных составила 2,6 %. В регистре Национального института здоровья из 236 случаев ЛАГ с неустановленной причиной 18 были связаны с ЗСТ (8%). В нескольких клинических центрах по ЛАГ более 10 % с тяжелой ЛАГ имеют ЗСТ, более часто – CREST-вариант склеродермии.
Патогенез
Гистопатологические изменения при ЛАГ, связанной с ЗСТ, обычно неотличимы от классической ИЛАГ. Более того, у этих пациентов описан целый спектр легочной сосудистой патологии, включая ЛВОБ и ЛКГ.
Патофизиологические механизмы, приводящие к развитию ЛАГ у больных с ЗСТ, остаются неизвестными. Гипотетически может играть роль спазм легочных сосудов, так называемый легочный феномен Рейно. Присутствие антинуклеарных антител, ревматоидного фактора, Ig-G и депонирование фракций комплемента в стенках легочных сосудов предполагает иммунологический механизм.
Клиническая картина и обследование
По сравнению с больными с ИЛАГ ЛАГ, связанная с ЗСТ, выявляется в основном у женщин более старшего возраста, характеризуется значительно сниженным сердечным выбросом и более короткой выживаемостью. По регистру Великобритании, средний период между постановкой диагноза системной склеродермии и выявлением ЛАГ составляет 14 лет, и это состояние, как правило, обнаруживается в среднем в возрасте 66 лет.
Клинические проявления очень похожи на ИЛАГ и иногда ЗСТ диагностируется по иммунологическим скрининговым тестам. КТВР используется в основном для исключения выраженного фиброза.
Летальность таких больных выше, чем при ИЛАГ (летальность в течение 1 года 40 % при развернутой стадии заболевания), прогностические факторы те же, что и для ИЛАГ (ДПП, ДЛА и сердечный индекс).
Эхокардиографическое обследование выполняется ежегодно у асимптоматических больных с заболеванием из группы склеродермии и только при клинических признаках ЛГ у больных с другими ЗСТ.
Целесообразность скрининга асимптоматических больных до конца неясна, потому что отсутствуют доказательства, что лечение у этих больных дает положительный результат. В любом случае раннее выявление любых симптомов, связанных с ЛАГ, должно служить поводом для тщательного и полного эхокардиографического обследования любого больного с ЗСТ в любой период болезни.
Как и при других формах ЛАГ, катетеризация правых отделов сердца рекомендуется во всех случаях при подозрении на ЛАГ, связанную с ЗСТ, для подтверждения диагноза, оценки тяжести и исключения патологии левых отделов сердца.
Лечение
Лечение ЛАГ, связанной с ЗСТ, более сложное по сравнению с лечением ИЛАГ. Иммуносупрессивная терапия эффективна только у небольшой части больных, в основном с заболеваниями, отличными от склеродермии.
Частота положительных вазодилатационных тестов и долговременного эффекта от лечения антагонистами кальция меньше, чем при ИЛАГ. Из соображений отношения риска и пользы пероральные антикоагулянты не всегда показаны.
Непрерывная терапия эпопростенолом улучшает переносимость физической нагрузки, уменьшает клинические проявления и гемодинамические нарушения, как было показано в 3-месячном рандомизированном исследовании больных с заболеваниями группы склеродермии. В этом исследовании не было получено улучшения выживаемости. Некоторые ретроспективные исследования показали, что влияние внутривенного эпопростенола на выживаемость больных с ИЛАГ лучше, чем при склеродермии. Эффективность непрерывного подкожного введения трепростинила была оценена у 90 больных с ЛАГ и ЗСТ, в том числе с системной красной волчанкой, диффузной склеродермией, ограниченной склеродермией и смешанными ЗСТ / перекрестным синдромом, которые вошли в более крупное РКИ по ЛАГ. Через 12 нед. было получено улучшение переносимости физических нагрузок, клинической картины ЛАГ и гемодинамики. Побочные эффекты включали боль в месте введения препарата и типичные побочные эффекты простагландинов.
Рандомизированное двойное слепое исследование, продолжавшееся 12 нед., с участием 47 больных с ЗСТ, показало, что босентан значительно улучшил переносимость физических нагрузок по сравнению с плацебо. Однако хотя у больных с ИЛАГ и с ЛАГ, связанной со склеродермией, был достигнут сходный эффект лечения, босентан увеличил пройденное расстояние у больных с ИЛАГ по сравнению с исходным (+46 м в группе босентана и -5 м в группе плацебо), в то время как у больных со склеродермией он предотвратил ухудшение физической толерантности (+3 м в группе босентана и -40 м в группе плацебо).
Таким образом, у больных с ЛАГ, связанной с ЗСТ, эффект лечения и долговременная выживаемость, очевидно, хуже, чем при ИЛАГ.
Легочная вено-окклюзивная болезнь и легочный капиллярный гемангиоматоз
Частота
Как легочная вено-окклюзивная болезнь, так и легочный капиллярный гемангиоматоз являются нечастыми заболеваниями, но они с возрастающей частотой становятся причинами ЛАГ. В литературе описано менее 200 случаев ЛВОБ и ЛКГ суммарно.
Патогенез
Как обсуждалось в разделе о клинической классификации и патоанатомии (см выше), ЛВОБ и ЛКГ имеют некоторое сходство, особенно в отношении изменений легочной паренхимы, например легочном гемосидерозе, интерстициальном отеке, увеличении лимфатических узлов, фиброзе интимы и гипертрофии медии легочных артерий.
Особый интерес представляют сообщения о семейных случаях ЛВОБ и ЛКГ, также как и ЛАГ. Недавно у больных с ЛВОБ были выявлены мутации гена BMPR2, связанного с семейной ЛАГ и ИЛАГ. Эти результаты подтверждают, что ЛВОБ, ЛКГ и ЛАГ могут быть разновидностями одной и той же болезни.
Клиническая картина и обследование
Клинические проявления у этих больных часто неотличимы от ИЛАГ. Однако врачебный осмотр может выявить отличия от ИЛАГ, например, утолщение дистальных фаланг пальцев рук и / или крепитацию в базальных отделах легких при аускультации.
Серии случаев показывают, что ЛВОБ / ЛКГ ассоциируются с более тяжелой гипоксемией и уменьшением DLco, в то время как показатели спирометрии и легочных объемов часто остаются в пределах нормы. Значительное снижение DLco можно объяснить хроническим интерстициальным отеком за счет обструкции легочных вен. Гемодинамические данные аналогичны ИЛАГ, хотя у некоторых больных гипоксемия может быть непропорциональна тяжести ЛАГ и дисфункции правых отделов сердца.
Интересно, что ЛДЗ часто остается нормальным несмотря на посткапиллярную патологию. В самом деле, патологические изменения обычно выявляются в венулах и не затрагивают более крупные вены. Изменения в мелких легочных венах не влияют на статический столб крови во время измерения ЛДЗ, поскольку соединение поддерживается более крупными непораженными легочными венами, в которых измеряется давление при окклюзии артериального сегмента.
В диагностике ЛВОБ / ЛКГ большую помощь могут оказать рентгенологические методы исследования. Наличие линий Керли В, плеврального выпота и очаговых изменений на стандартной рентгенограмме грудной клетки позволяет выставить предположительный диагноз.
КТ легких с тонкими срезами выявляет характерные изменения. Чаще всего обнаруживаемыми изменениями являются очаговые центрилобулярные изменения по типу "матового стекла", утолщение септальных перегородок, плевральный выпот и лимфоаденопатия
средостения. Эти изменения тесно коррелируют с развитием отека легких при внутривенном введении эпопростенола: симптом "матового стекла" встречается значительно чаще при ЛВОБ / ЛКГ, чем при ИЛАГ (р = 0,003). При ЛВОБ / ЛКГ очаги "матового стекла" более многочисленные. Важны морфологические характеристики симптома "матового стекла". Центрилобулярное распространение (нечетко очерченные центрилобулярные узловые затемнения) чаще встречаются при ЛВОБ / ЛКГ, чем при ИЛАГ (р = 0,003). Наоборот, панлобулярное распространение (относительно хорошо очерченные географические зоны затемнений легочной ткани) выявляются в обеих группах и не имеют определяющего значения в диагностике. Субплевральные септы (p < 0,0001) и лимфоаденопатия также встречаются гораздо чаще при ЛВОБ / ЛКГ, чем при ИЛАГ. Взаимосвязь этих трех признаков очень специфична для ЛВОБ (специфичность 100 %) с чувствительностью 66 %.
Таким образом, при первой рентгенографии легких до начала лечения сочетание симптома "матового стекла" (особенно с центрилобулярным распространением), септы и лимфоаденопатия у больных с клинической картиной ЛАГ показательны для ЛВОБ / ЛКГ. При наличии таких рентгенологических изменений следует с осторожностью подходить к вопросу о вазодилатирующей терапии.
Дополнительными методами исследования для диагностики ЛВОБ / ЛКГ являются бронхоскопия с бронхо-альвеолярным лаважом (БАЛ). По сравнению с ИЛАГ ЛВОБ / ЛКГ характеризуются значительным увеличением клеточности БАЛ.
Однако процент макрофагов, нейтрофилов и лимфоцитов при этих трех состояниях аналогичен. Поскольку ЛВОБ / ЛКГ поражают посткапиллярную сосудистую сеть, они обычно сопровождаются скрытыми альвеолярными кровотечениями и появлением нагруженных гемосидерином макрофагов. В недавнем исследовании процент нагруженных гемосидерином макрофагов был выше при ЛВОБ, чем при ИЛАГ (54 ± 37 % по сравнению с 3 ± 6 %, р = 0,0006). Балл по шкале Golde значительно выше при ЛВОБ (109 ± 97 против 4 ± 10, р = 0,0004).
В заключение, сочетанное подтверждение ЛАГ, повышение числа макрофагов, нагруженных гемосидерином, в БАЛ и интерстициальные легочные инфильтраты делают диагноз ЛВОБ / ЛКГ высоковероятным.
Лечение
В новой клинической классификации ЛВОБ и легочная венозная гипертензия включены в раздел включены в группу ЛАГ, связанной со значительными изменениями вен или капилляров. Вероятно, эта группа требует такого же лечения, как другие виды ЛАГ. Однако прогноз у этих больных хуже, с более быстрым прогрессированием заболевания. Кроме того, вазодилататоры и особенно эпопростенол должны применяться с большой осторожностью из-за высокого риска развития отека легких.
Однако имеются сообщения о стабильном клиническом улучшении у отдельных больных при лечении этими препаратами. Данные по использованию новых видов терапии, таких как АЭР, при ЛВОБ / ЛКГ отсутствуют. Назначение любых лекарственных препаратов этим больным должно проводиться только в клинических центрах с широким опытом диагностики и ведения больных с ЛАГ, и риск должен быть оценен до начала лечения.
Предсердная септостомия может проводиться, как других формах ЛАГ, но ограничена из-за гипоксемии, которая при ЛВОБ / ЛКГ встречается чаще, чем при других формах ЛАГ.
Единственным методом лечения при ЛВОБ / ЛКГ является трансплантация легких, и, как и при ИАЛГ, после трансплантации случаи рецидива заболевания не описаны.


