 Начало развития катетерной техники относится к глубокой древности. За 3 000 лет до н. э. египтяне впервые в мире выполнили катетеризацию мочевого пузыря, используя металлические трубки. С этого момента началась эра инвазивных вмешательств в человеческий организм.
Начало развития катетерной техники относится к глубокой древности. За 3 000 лет до н. э. египтяне впервые в мире выполнили катетеризацию мочевого пузыря, используя металлические трубки. С этого момента началась эра инвазивных вмешательств в человеческий организм.
Примерно за 400 лет до н. э. люди научились придавать изогнутую форму трубкам из полого тростника и использовали их на трупах для изучения анатомии и функции клапанов сердца.
В 1711 г. голландский физиолог Н. Hales выполнил первую катетеризацию полости сердца у лошади с помощью трубок из латуни, стекла и гусиной трахеи.
В 1844 г. французский физиолог Е. Bernard произвел зондирование камер сердца у животных с записью внутрисердечного давления. В 1895 г. W. Roentgen открыл неизвестные дотоле лучи, названные им Х-лучами. А уже в 1896 г. В. М. Бехтерев предсказал открытие ангиографии. Выдающийся русский невролог заметил: «...Раз стало известно, что некоторые растворы не пропускают лучи Рентгена, то сосуды мозга могут быть заполнены ими и сфотографированы in situ». Однако понадобилось более тридцати лет, чтобы эти смелые предположения были реализованы на практике.
Годом возникновения интервенционной кардиологии можно считать 1929, когда интерн медицинского университета W. Forssman в эксперименте на себе впервые в мире провел мочеточниковый катетер через локтевую вену в полость правого предсердия, доказав тем самым безопасность введения катетера в живое сердце человека. Через два года он описал первую в истории ангиокардиографию, выполненную на самом себе. За эти дерзкие опыты на себе он был немедленно уволен из клиники в городе Эберсвальд (Германия) и лишен на всю жизнь возможности заниматься кардиологией. 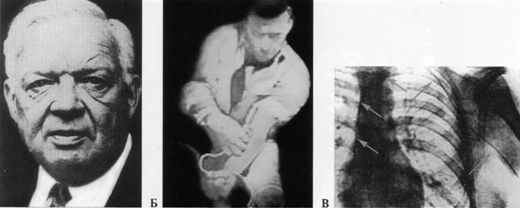
Рисунок: W. Forssman и первая в истории процедура катетеризации сердца, выполненная им на самом себе.
А — W. Forssman; Б — момент проведения катетера через локтевую вену; В — на рентгенограмме зафиксирован катетер, проведенный в правое предсердие (стрелки).
Медицинское сообщество проигнорировало его опыты и долгое время презрительно относилоськ нему. В 1941 г. A. Cournand и D. Richards впервые использовали сердечный катетер как диагностический инструмент, чтобы определить функциональное состояние сердца. И только в 1956 г., спустя 27 лет после отчаянного эксперимента W. Forssman, ученые из США A. Cournand и D. Richards были номинированы на Нобелевскую премию «за открытие, связанное с катетеризацией сердца и патологическими изменениями в системе кровообращения». Они предложили Нобелевскому комитету включить в список соискателей и своего немецкого коллегу, отметив, что начали свои исследования под влиянием его работ 20—30-х годов. Предложение было принято комитетом, и им была присуждена Нобелевская премия. На церемонии вручения премии A. Cournand во вступительной речи обобщил состояние вопроса крылатой фразой: «Сердечный катетер был ключом в замке». По иронии судьбы после смерти W. Forssman в 1979 г. клиника в Эберсвальде близ Берлина стала называться его именем.
В 1953 г. S. Seldinger предложил пункционный доступ в артерию, которым пользуются до сих пор.
В 1958 г. М. Sones впервые зафиксировал рентгеноконтрастное изображение коронарных артерий на кинопленку при выполнении аортографии у больного с поражением
аортального клапана. Он был детским кардиологом в Кливлендском центре. В дальнейшем исследователь предложил собственную методику диагностической коронарной ангиографии и сконструировал несколько моделей соответствующих катетеров.
В. П. Демихов в начале 50-х годов XX в. разработал методики маммарно-коронарного анастомоза в эксперименте на собаках, и его работы послужили основанием для внедрения В. И. Колесовым подобной операции в клиническую практику в 1964 г.
В 1964 г. Ch. Dotter и М. Judkins предложили новый транскатетерный метод восстановления атеросклеротически суженных и окклюзированных периферических артерий, который внес кардинальные изменения в лечение атеросклероза.
В 1967 г. впервые была представлена методика коронарографии по Judkins и одновременно R. Favaloro в Кливленде (США) впервые в мире выполнил операцию аортокоронарного венозного шунтирования. В 1969 г. R. Myler сконструировал приспособление для механической дилатации коронарных артерий, но ему не удалось разработать эффективную методику применения этого устройства в коронарном русле. Параллельно этим исследованиям A. Gruentzig в Цюрихе занимался вопросами периферической ангиопластики. Вскоре ему удалось в несколько раз уменьшить размер баллонного катетера для периферической ангиопластики и успешно использовать его для дилатации периферических и коронарных сосудов у собак.
В 1974 г. A. Gruentzig выполнил первую процедуру периферической ангиопластики. В 1976 г. он представил результаты экспериментальных работ по коронарной баллонной ангиопластике на животных, однако они получили мало отзывов и рассматривалисьс большим скептицизмом. В 1976 г. R. Myler и A. Gruen-tzig решили сотрудничать в поисках эффективного и безопасного способа выполнения коронарной баллонной ангиопластики.
В 1977 г. с участием A. Gruentzig, R. Myler и Е. Наппа в Сан-Франциско была выполнена первая интраоперационная коронарная баллонная ангиопластика. В 1977 г. A. Gruentzig и соавт. после многочисленных экспериментов на собаках впервые в клинической практике выполнили пациенту под местной анестезией успешную процедуру транслюминальной баллонной ангиопластики (ТЛБАП), таким образом начав эру коронарной ангиопластики. A. Gruentzig создал однопросветный, а затем двухпросветный баллонные катетеры и разработал показания к применению баллонной ангиопластики коронарных артерий. В СССР первую селективную коронарографию выполнили в 1971 г. Ю. С. Петросян и Л. С. Зингерман в Институте сердечно-сосудистой хирургии им. А. Н. Бакулева АМН СССР, в дальнейшем опубликовав в 1974 г. первую в стране монографию по коронарографии. Первую процедуру коронарной баллонной ангиопластики в 1982 г. вы-полнили И. X. Рабкин и А. М. Абугов во Всесоюзном научном центре хирургии. И. X. Рабкин и соавт. в дальнейшем выпустили монографию по рентгеноэндоваскулярной хирургии, где подробно описали технику выполнения процедуры.
В 1982 г. J. Simpson и соавт. предложили новый тип проводника для коронарной ангиопластики — тонкий длинный металлический проводник с гибким направителем-кончиком J-образной формы длиной от 1 до 3 см. С тех пор стало возможным направлять коронарный проводник в нужную сторону, а следовательно, полностью контролировать пе-редвижение проводника и соответственно баллонного катетера. Таким образом, катетеры для коронарной ангиопластики стали управляемыми. Это способствовало работе на более дистальных участках коронарных артерий и повышению эффективности вмешательства. Так, после 1982 г. технический успех ТЛБАП резко возрос — с 65—70 до 80—85%.
В 1984 г. М. Kaltenbach и соавт. в Германии предложили технику применения длинного проводника для замены баллонных катетеров и введения рентгеноконтрастного вещества в коронарную артерию.
1985 год стал годом больших потерь в истории интервенционной медицины: скончались Ch. Dotter, F. Sones, M. Judkins и A. Gruentzig, навсегда вписав свои имена в историю становления интервенционной кардиологии и эндоваскулярной хирургии.
В 1986 г. Т. Bonzel и соавт. ввели новую концепцию «монорельсовых» катетеров для коронарной ангиопластики, с коротким дистальным сегментом, скользящим по металлическому проводнику.
В 1988 г. В. Meier и соавт. предложили проводниковую систему для реканализации окклюзированных коронарных артерий и прохождения жестких критических стенозов коронарных сосудов. Устройство имело на конце металлическую оливу диаметром до 2 мм и относительно жесткий стилет, что позволяло улучшить прохождение проводника через пораженный сегмент.
Высокая частота рестеноза, составляющая, по данным разных авторов, от 13 до 47%, а также острой окклюзии и остаточного стеноза после ТЛБАП, вызвали необходимость разработки новых манипуляций, дополняющих традиционную ТЛБАП. Разработанные приспособления стали называть устройствами второго поколения.
Идея о возможности использования чрескожно вводимых устройств-протезов (стентов) для поддержания просвета пораженного кровеносного сосуда впервые была предложена Ch. Dotter и соавт. в 1964 г.
Первое стентирование коронарной артерии у человека выполнили J. Puel и соавт. в марте 1986 г. в Тулузе (Франция), и практически одновременно с ними U. Sigwart и соавт. в Лозанне (Швейцария) сообщили о результатах стентирования 24 коронарных артерий у 19 пациентов. Опираясь на результаты опытов чрескожной имплантации металлических стентов в сосуды животных и затем в периферические артерии человека, авторы произвели первую чрескожную имплантацию металлического стента в коронарную артерию человека. Этим вмешательством открылась новая эра дистанционного проведения постоянных коронарных эндопротезов (стентов) в рентгенооперационной с использованием техники коронарной ангиопластики.
Американская администрация по продовольствию и лекарствам — Food and Drug Administration (FDA) — в 1987 г. дала разрешение на проведение в США исследований по применению баллонорасширяемых интракоронарных стентов Gianturco—Roubin и Palmaz—Schatz. Потенциальное преимущество интракоронарного стентирования для лечения острых и угрожающих окклюзии, осложняющих коронарную баллонную ангиопластику, было продемонстрировано G. Roubin и соав. В 1987—1989 гг. баллонорас-ширяемые стенты Gianturco—Roubin, произведенные компанией «СООК», были успешно имплантированы всем 115 пациентам, включенным в исследование. Хороший непосредственный результат процедуры был достигнут в 93% случаев. Экстренное аортокоронарное шунтирование потребовалось в 4,2% случаев, общая частота инфаркта миокарда составила 16%, частота подострого тромбоза стента — 7,6%, госпитальная летальность — 1,7%. Эти данные показали, что стентирование при острой или угрожающей окклюзии сосуда снижает необходимость в аортокоронарном шунтировании и частоту инфарктов миокарда. Вместе с тем в связи с высокой частотой возникновения рестеноза, составившей 41% (сходной с частотой рестеноза после баллонной ангиопластики в случае острой или угрожающей диссекции), стало ясно, что стентирование не имеет преимуществ в плане отдаленных результатов. В 1993 г. FDA разрешила применение стента Gianturco—Roubin для лечения острых и угрожающих окклюзии коронарных артерий, осложняющих ТЛБАП; в 1994 г. было получено разрешение на применение стента Palmaz—Schatz для лечения первичных дискретных стенозов нативных коронарных артерий. К 1998 г. разрешение FDA было получено еще для трех стентов: Multi-Link, AVE GFX и NIR.
В период с 1986 по 2000 г. в клиническую практику были внедрены новые технологии коронарной ангиопластики: лазерная реканализация и ангиопластика эксимерным лазе-ром, направленная коронарная атерэктомия, основанная на разработках J. Simpson, транслюминальная экстракционная атерэктомия, ротаблаторная атерэктомия, коронарная ангиопластика фокусированной силы, использование радиоактивных стентов, систем интракоронарной тромбэктомии AngioJet и X-sizer и многое другое.
Девяностые годы XX столетия стали эпохой расцвета эндоваскулярной хирургии. В ближайшие годы мы можем ожидать совершенствования конструкции и технологии интервенционного оборудования. Катетерная техника достигла высокого уровня развития. Практически ежегодно возникают высокотехнологические новшества. Части из них суждено остаться в истории интервенционной кардиологии, а части — стать совершенным орудием оператора. И только большой экспериментальный и клинический опыт сможет определить место каждого метода в эндоваскулярной хирургии ишемической болезни сердца.
За последнее десятилетие коронарное стентирование стало новым ведущим стандартом в эндоваскулярном лечении ИБС. Однако долгосрочному успеху коронарного стентирования препятствовало развитие рестеноза внутри стента в отдаленном периоде. Это представляет основную проблему для современной интервенционной кардиологии, поскольку количество рестенотических поражений коронарных артерий постоянно увеличивается, параллельно устойчивому росту количества процедур стентирования в мире, а лечение таких поражений технически осложняет процедуру стентирования и ведет к значительному увеличению общей стоимости лечения пациентов.
Полученный за последние шесть лет опыт использования стентов с антипролиферативным покрытием показал их явное преимущество в борьбе с рестенозом. Сегодня растет количество клинических исследований, подтверждающих высокую эффективность различных стентов с антипролиферативным покрытием в предотвращении развития рестеноза внутри стента.
Хотя остается еще много вопросов, на которые предстоит ответить в будущем, но уже сейчас понятно, что данное направление в эндоваскулярной хирургии коронарных сосудов является перспективным и привлекательным для врачей и пациентов.
Рентгеноэндоваскулярная хирургия ишемической болезни сердца
Л. А. Бокерия, Б. Г. Алекян, С. П. Глянцев, Н. В. Закарян


