Тромбоэмболия легочной артерии (ТЭЛА) - третья по частоте после патологии сердца и злокачественных опухолей причина смерти. Приблизительно 75% патологоанатомически доказанных случаев не проявляются клинически.
Dalen выявил, что в Соединенных Штатах легочная эмболия развивается у 630 000 больных ежегодно. Из госпитализированных с ТЭЛА 12-21% пациентов погибают в стационаре и 24-39% умирают в течение 12 месяцев. Таким образом, 36-60% пациентов, которые переживают начальный эпизод, имеют различные клинические проявления постэмболического синдрома. Более 90% клинически диагностированных ТЭЛА связаны с тромбозом глубоких вен нижних конечностей, который у 2/3 больных протекает бессимптомно.
Прогноз для пациентов с легочной гипертензией неблагоприятен, особенно у тех из них, кто не имеет внутрисердечного шунта. Фактически, как только среднее легочное давление у пациентов ТЭЛА достигает 50 мм рт.ст. или выше, 3-летняя смертность приближается к 90%. Варианты хирургического лечения зависят и от первичного процесса болезни и от обратимости легочной гипертонии. Трансплантация легкого - единственный эффективный метод лечения пациентов с легочной гипертонией в терминальной стадии. Вместе с тем, связанные с ней побочные эффекты: более высокая смертность, длительное время ожидания и неудовлетворительный прогноз по сравнению с тромбэндартерэктомией делает трансплантацию проблематичной.
Тромбоз глубоких вен – основная причина ТЭЛА
Тромбоз глубоких вен прежде всего, затрагивает вены нижних конечностей и редко венозную систему в другом месте. Легочная эмболия также может быть следствием тромбоза правого предсердия, желудочка или печеночных вен. При микроскопическом исследовании тромбы выявляются в области клапанов вен. Тромбы состоят из фибрина, тромбоцитов большого эритроцитов.
Патогенез
В 1856 г. Rudolf Virchow предположил, что причины образования тромбов связаны с венозным застоем, повреждением стенки вены и гиперкоагуляцией. Эта триада этиологических факторов остается уместной сегодня и подтверждается растущим количеством современных исследований. Цитокины, интерлeйкин-I и фактор некроза опухоли, производимые макрофагами и другими клетками в различных патологических условиях стимулируют деятельность прокоагулянта эндлотелиальных клеток. Эти процессы могут объединиться с венозным застоем, микроскопическими повреждениями эндотелия, деятельностью прокоагулянтов крови, чтобы стимулировать формирование начального тромба в венозных карманах клапанов глубоких вен нижних конечностей. Некоторые пациенты с тромбозом глубоких вен имеют дефицит естественных антикоагулянтов: антитромбина - естественной плазменной протеазы, которая предотвращает образование тромбина; C-белка - мощного ингибитора V и VII факторов свертывания и S-белка, как кофактора для деятельности антикоагулянтов. У 6-7% населения гомо- и гетерозиготные мутации указанных факторов связаны с венозным тромбозом и легочной эмболией, в отличие от артериальных тромбозов при инфаркте миокарда.
В дополнение к трем классическим факторам риска, описанным выше, уменьшенная фибринолитическая активность крови может также внести свой вклад в развитие тромбоза. Снижение фибринолитической активности может быть следствием уменьшенного производства тканевого активатора профибринолизина (t-Пенсильвания) или увеличения концентрации ингибитора активатора профибринолизина-I. Кроме того, отмечено, что активность фибринолитиков меньше в венах нижних, чем в верхних конечностей, особенно у пожилых пациентов.
Наличие главных факторов риска увеличивает вероятность венозной томбоэмболии. У пациентов с клинически подозреваемым тромбозом глубоких вен - 50% с тремя факторами риска имеют доказанный диагноз тромбоза. С другой стороны, при отсутствии любых факторов риска тромбозы отмечены только в 11% больных.
Предыдущие томбоэмболии, пожилой возраст, хирургические операции на бедре или колене, множественная травма, и злокачественные опухоли – также серьезные факторы риска. У пациентов с венозной томбоэмболией в анамнезе риск развития нового эпизода в течение госпитализации - почти в восемь раз больше чем других больных. У 10% пациентов с первым эпизодом тромбоза глубоких вен или ТЭЛА и до 20% с текущим заболеванием развивается новый эпизод венозной тромбоэмболии в течение 6 месяцев. Больные в 70-80-летнем возрасте в 200 раз чаще страдают ТЭЛА, чем пациенты в возрасте < 40 лет, мужчины чаще, чем женщины. Неподвижность вследствие любой причины – главный фактор риска тромбоза глубоких вен (у 15-80% пациентов он развивается при постельном режиме в течение 1 недели).
Без профилактики риск тромбоза глубоких вен и ТЭЛА при брюшной хирургии составляет 25% и 2% соответственно, а после множественной травмы - более чем у 50% пациентов с тазовыми или бедренными повреждениями. Простые профилактические меры типа эластичных чулков и использование низкомолекулярных гепаринов уменьшают частоту тромбоза глубоких вен после хирургических вмешательств на 40%.
Особенно интересны недавние наблюдения, доказывающие, что клинически бессимптомный тромбоз глубоких вен развивается в течение госпитализации почти у 50% пациентов после реваскуляризации миокарда, а ТЭЛА - у 3,2 %. Факторы риска развития этого осложнения включают продленное пребывание в отделении интенсивной терапии, предшествующие тромбоэмболии, ожирение и гиперлипедемия. Госпитальная летальность у больных с ТЭЛА составляет 18,7%. Интересно, что протезирование клапанов сердца не сопровождалась развитием тромбоэмболии.
Диагностика тромбоза глубоких вен
Самый популярный неинвазивный тест, который может быть проведен у постели больного - допплерография сосудов нижних конечностей. В руках квалифицированных исследователей тромбоз глубоких вен нижних конечностей диагностируется у 89-100% пациентов. ЯМР второй метод, который способен отобразить всю венозную систему, включая вены верхних конечностей и средостения.
Естественное течение ТЭЛА
Летальность при ТЭЛА без лечения составляет 18-33%, но может быть уменьшена до 8% если проведена своевременная диагностика и лечение. 75-90% пациентов умирают в течение первых нескольких часов после эмболии. У больных с нормальной функцией правого желудочка, переживших начальные несколько часов, за следующие несколько дней и недель происходит автолиз эмбола. В среднем, 20% массы тромба лизируется за 7 дней, а полный лизис происходит за 2-4 недели.
История хирургического лечения тромбоэмболии легочной артерии (ТЭЛА)
История хирургического лечения тромбоэмболии легочной артерии (ТЭЛА) насчитывает уже не одно десятилетие. Несколько поколений хирургов брались за ее решение, постоянно сталкиваясь с трагическими случаями смерти больных от массивной легочной эмболии. Накопленный опыт поистине бесценен.
Первый этап (1908-1939 гг.)
Впервые о возможности хирургического лечения тромбоэмболии ствола и главных ветвей легочной артерии заявил в 1908 году известный немецкий хирург Ф. Тренделенбург. Однако если хирурги сталкивались с необходимостью эмболэктомии, то чаще всего такие попытки оказывались неудачными. Тем не менее, в 30-е годы прошлого столетия появился ряд сообщений об успешных оперативных вмешательствах. При этом методика эмболэктомии претерпела ряд изменений.
Второй этап (1940-1958 гг.)
Сопровождался значительной летальностью, несовершенством анестезиологического и реанимационного обеспечения. Критическое осмысление опыта предшествующих операций заставило хирургов задуматься о показаниях к этому вмешательству и методике его проведения. Уже в эти годы появилось мнение, что больных с массивной тромбоэмболией легочной артерии следует оперировать раньше, то есть, необходим пересмотр традиционных показаний к эмболэктомии, нашедших отражение в словах A. Meyer (1930): «Дождаться смерти, чтобы оперировать».
Третий этап (1959-1967 гг.)
Весь ход развития хирургии, прогресс в оперативном лечении заболеваний сердца и сосудов не могли не сказаться на судьбе легочной эмболэктомии. В 1959 г. году K. Vossschulte, H. Stiller сформулировали основные требования к методике эмболэктомии. Она должна, по их мнению, обеспечивать возможность:
2) быстрого подхода к сердцу,
3) устранения опасной дилатации правого желудочка.
Применение эмболэктомии в условиях окклюзии путей притока к правым отделам сердца позволило значительно улучшить результаты хирургического лечения тромбоэмболии легочной артерии. Поиск более безопасных способов эмболэктомии вскоре привел к использованию общей гипотермии, а затем и искусственного кровообращения. Успешная эмболэктомия в условиях экстракорпорального кровообращения была осуществлена в 1961 г. году сначала E.Sharp, а вскоре после него D. Cooley и соавт. (1961).
Общая гипотермия не получила распространения, поскольку на охлаждение организма больного уходило довольно много времени. Вместе с тем, использование искусственного кровообращения открыло новые горизонты в лечении этого заболевания, так как позволило: осуществить наиболее полную декомпрессию правых отделов сердца без тяжелых последствий гипоксии внутренних органов, оперировать в спокойной обстановке и добиться более полноценного восстановления проходимости легочного сосудистого русла, уже в процессе операции устранить гипоксемию и корригировать тяжелые метаболические расстройства.
Четвертый этап (1968-1975 гг.)
В конце 60-х годов, казалось, ничто уже не может поколебать уверенности хирургов в необходимости легочной эмболэктомии. Однако вскоре появились работы, свидетельствующие о высокой эффективности лечения тромбоэмболии легочной артерии с помощью стрептазы и урокиназы. Быстрое восстановление проходимости сосудистого русла легких при применении этих средств даже послужило основанием назвать тромболитическую терапию «медикаментозной эмболэктомией».
Пятый этап (1976 г. - по настоящее время)
К середине 70-х годов стало ясно, что тромболитики не являются панацеей и их применение не может исключить необходимости оперативного лечения целого ряда больных с тромбоэмболией ствола и главных легочных артерий. Еще в предыдущие годы, по мере накопления опыта тромболитической терапии, стали появляться сообщения о ее неэффективности в некоторых случаях. Возникло новое показание для эмболэктомии: неэффективность применения тромболитиков. «Хирурги должны оперировать больных в терминальном состоянии или тех, у которых консервативное лечение оказалось безуспешным», - писал M.Kim в 1976 г. На практике это нередко означает, что вопрос об операции ставился, как и во времена Тренделенбурга, лишь тогда, когда состояние больных становилось агональным. Следует также отметить, что предварительное использование фибринолитических средств в значительной мере затрудняет оперативное вмешательство и даже может рассматриваться в качестве противопоказания к нему.
Таким образом, проблема лечения массивной легочной тромбоэмболии содержит в себе весьма сложную тактическую дилемму: что более предпочтительно – опасное и тяжелое оперативное вмешательство, гарантирующее быструю реканализацию пораженных сосудов, или менее травматичное консервативное лечение с непредсказуемым результатом? Эта альтернатива должна решаться на основании прогностических критериев течения и исхода заболевания.
У целого ряда больных после острейшего эмболического эпизода с асфиксией, шоком и даже кратковременной асистолией реанимационные мероприятия оказываются успешными. Это вселяет надежду на эффективность дальнейшего консервативного лечения, а мысль об эмболэктомии (травматичном и опасном оперативном вмешательстве) отодвигается на задний план. Часто вслед за этим периодом кажущегося благополучия вновь наступает резкое ухудшение гемодинамики, обусловленное не повторной эмболией, а декомпенсацией правого желудочка. Прогнозировать подобный исход тромбоэмболии легочных артерий, а значит, и решиться на эмболэктомию, следует до развития необратимой декомпенсации кровообращения, лучше при нормальном уровне системного артериального давления.
Некоторые авторы считали неблагоприятным прогностическим признаком и одновременно показанием для эмболэктомии значительное повышение давления в правом желудочке. Вместе с тем, описаны случаи выживания больных и полного восстановления проходимости сосудов малого круга кровообращения у больных с выраженной легочной гипертензией. С другой стороны, эмболэктомия может быть иногда необходима даже при нормальном давлении в правых полостях сердца. По мнению A.Beall и соавт. (1965), P. Ebert (1974), давление остается повышенным до тех пор, пока сохранена сократительная способность миокарда правого желудочка и сердечный выброс снижен не столь значительно. «Нормализация» давления может произойти при развитии декомпенсации правого сердца. По этой же причине не имеет решающего значения величина давления в легочной артерии.
Выраженная гипертензия малого круга может быть при небольшой тромбоэмболии, если она развилась на фоне тяжелой сердечно-легочной патологии. Вот почему многие исследователи полагали, что решающее значение в выборе метода лечения имеет объем эмболического поражения. В качестве критического уровня в большинстве случаев указывали на выключение из кровообращения 50% и более легочного артериального русла. Однако, по мнению R.Kieny и соавт. (1976), величина окклюзии, равная 50%, как правило, неплохо переносится больными и поддается лечению троболитиками, а выключение 70% легочного кровотока ведет к высокой летальности при проведении консервативного лечения. По данным H. Just и соавт. (1979), при обструкции свыше 60% легочного русла выживает не более 20-40% больных. Аналогичного мнения придерживаются P. Puech (1972), F. Achard и соавт. (1981).
Приведенные литературные сведения указывают на то, что критический уровень объема эмболического осложнения нельзя считать окончательно определенным. К тому же известны случаи выздоровления больных с распространенной окклюзией сосудистого русла легких.
Неопределенность прогноза массивной легочной эмболии, основанного на каком-либо показателе, заставила искать комплекс признаков, характеризующих чаще всего тяжесть нарушения легочной перфузии и гемодинамических расстройств. По данным D. Tibbutt и соавт. (1974), при сочетании системной артериальной гипотензии и величины ангиографического индекса Миллера, превышающей 24 балла, летальность составляет 70%, и возникает необходимость срочной эмболэктомии. По данным R. Jones, D. Sabiston (1976), повышение систолического давления в малом круге > 55 мм рт.ст., окклюзия более 50% артериального русла легких и уровень артериального насыщения О2 < 55 мм рт.ст. приводят к смерти 43% больных. Летальность при массивной тромбоэмболии легочных артерий, обусловившей артериальную гипотензию большого круга, равна, по мнению J. Alpert и соавт. (1976), 32%. Вместе с тем, прогностические критерии, правильно предсказывающие исход заболевания только у половины больных, трудно применять в клинической практике.
Другим фактором, который должен определять хирургическую тактику, является вероятность развития в отдаленном постэмболическом периоде тяжелой хронической легочной гипертензии. О подобном исходе заболевания неоднократно сообщалось. К сожалению, прогнозировать возникновение такого позднего осложнения очень трудно. R. Sautter и соавт. (1975) считают развитие хронической постэмболической легочной гипертензии редким исходом массивной тромбэмболии. M. Paneth (1967) полагает, что полноценного восстановления проходимости главных легочных артерий при тромбэмболической их окклюзии никогда не происходит, даже если больные переживают острую стадию заболевания.
Подводя исход вышеизложенному можно отметить, что показания должны определяться характером поражения легочного артериального русла, а также состоянием гемодинамики в большом и малом кругах кровообращения. Ниже приводится классификация В.С.Савельева (1990) на основе которой автор предлагает определять показания к выполнению экстренной эмболэктомии.
Классификационно-оценочные критерии тромбоэмболии легочных артерий
I. Локализация
А. Проксимальный уровень эмболической окклюзии:
2) долевые и промежуточные артерии;
3) главные легочные артерии и легочный ствол.
Б. Сторона поражения:
2) правая;
3) двустороннее.
II. Степень нарушения перфузии легких
| Степень | Ангиографический индекс (баллы) | Перфузионный дефицит (%) |
| I (легкая) | < 16 | < 29 |
| II (средняя) | 17-21 | 30-44 |
| III (тяжелая) | 22-26 | 45-59 |
| IV (крайне тяжелая) | ≥ 27 | ≥ 60 |
III. Характер гемодинамических расстройств
| Гемодинамические расстройства | Давление в правом желудочке (мм рт.ст.) | СИ л/мин/м2 | ||||
| в аорте | систолическое | конечно-диастолическое | среднее | в легочном стволе | ||
| Умеренные или без них | > 100 | < 40 | < 10 | < 19 | < 25 | ≥ 2,5 |
| Выраженные | > 100 | 40-59 | 10-14 | 19-24 | 25-34 | ≥ 2,5 |
| Резко выраженные | > 100 | ≥ 60 | ≥ 15 | ≥ 25 | ≥ 35 | < 2,5 |
IV. Осложнения
А. Инфаркт легкого (инфарктная пневмония).
Б. Парадоксальная эмболия большого круга кровообращения.
В. Хроническая легочная гипертензия.
Составляя программу лечения больного с тромбоэмболией главных легочных артерий, врач должен предусмотреть необходимость:
2) нормализацию перфузии и предотвращение тяжелой гипертензии малого круга кровообращения – в отдаленном;
3) надежную профилактику повторных эмболий.
Экстренная эмболэктомия
Время становится главным фактором выживаемости пациентов. Большинство летальных исходов от острой легочной эмболии происходит прежде, чем начато эффективное лечение. 11% пациентов с фатальной ТЭЛА умирают в течение первого часа, 43-80% - в течение двух часов, и 85% - в течение 6 часов.
В значительной степени, обстоятельства и своевременная готовность необходимого оборудования и персонала определяют варианты лечения. Такие факторы, как преклонный возраст, повреждение головного мозга и т.д. с одной стороны делают хирургическое лечение бесперспективным, с другой стороны, стабилизация гемодинамики может отсрочить операцию. Иногда экстренное хирургическое лечение недоступно. Адекватный прогноз лечения с использованием терапевтического или хирургического подхода при массивной легочной эмболии оставляет проблему выбора тактики лечения нерешенной.
Острая легочная эмболия обычно проявляется внезапно. Клинические симптомы зависят от степени блокирования ЛА, величины гуморального ответа и состояния контрактильности ПЖ. Признаки широко варьируют и в этой связи прижизненный диагноз ставиться только у 16-38% пациентов.
Наиболее часто легочная эмболия незначительна (мелкие ветви ЛА). У этих пациентов наблюдается внезапное необъяснимое беспокойство, тахипноэ или одышка, боль груди, кашель. Аускультативно тоны сердца не изменены, иногда выслушивается шум трения плевры. Насыщение артериальной крови кислородом (PaO2) – 65-80 мм рт.ст., а углекислым газом - PaCO2 составляет 35 мм рт.ст. Легочные ангиограммы при этом показывают меньше чем 30% окклюзию легочного сосудистого русла.
Эмболия главных ветвей легочной артерии связана с одышкой, тахипноэ, болью в груди, и гемодинамической нестабильностью, проявляющейся тахикардией и повышением ЦВД. У некоторых пациентов наблюдается обморок. В отличие от массивной легочной эмболии, пациенты с эмболией главных ветвей (по крайней мере двух долевых) легочной артерии имеют адекватный сердечный выброс. Насыщение артериальной крови кислородом показывает умеренную гипоксию (PaO2) – <65>50 мм рт.ст.) и гипокарбию (PaCO2) < 30 мм рт.ст). На ЭхоКГ может быть выявлена дилатация ПЖ. Легочные ангиограммы указывают, что 30-50% легочного кровеносного русла блокировано.
Массивная легочная эмболия действительно опасна для жизни и вызывает гемодинамическую нестабильность, так как больше чем 50% легочного сосудистого русла окклюзировано. Для этого состояния характерны гипотония и низкий сердечный выброс (<1,8 л/мин/м2). У пациентов появляется острая одышка, тахипноэ, тахикардия, иногда потеря сознания и остановка сердца. Развивается недостаточность правого желудочка, ЦВД увеличено. Анализ газов крови показывает серьезную гипоксию (PaO2) < 50 мм рт.ст.), гипокарбию (PaCO2) < 30 мм рт. ст.) и иногда ацидоз. Наблюдается падение диуреза.
Диагностика
Клинический диагноз массивной легочной эмболии не подтверждается после ангиографии у 70-80% пациентов.
Дифференциальный диагноз от острого инфаркта миокарда, расслаивающей аневризмы аорты и других катастроф часто затруднен. Простая рентгенограмма грудной клетки, ЭКГ и введение катетера Swan-Ganz могут добавить подтверждающую информацию. На рентгенограмме обычно выявляется ателектаз или характерная треугольная инфильтрация легочной ткани и экссудат в плевральной полости. Перегрузка ПЖ или блокада правой ножки пучка Гиса на ЭКГ отмечается только у 26% пациентов с массивной эмболией. ЭхоКГ выявляет дилатацию ПЖ. Давление в ЛА обычно не превышает 40 мм рт.ст вследствие острой недостаточности ПЖ. Легочные ангиограммы обеспечивают самый точный диагноз, но из-за неустойчивой гемодинамики часто не могут быть выполнены до стабилизации пациента.
ЯМР томография - лучший неинвазивный метод для постановки диагноза легочной эмболии. К сожалению, метод является дорогим, трудоемким, трудно доступным и не подходящим для гемодинамически нестабильных пациентов.
Трансторакальная и транспищеводная ЭхоКГ с цветным допплером могут обеспечить надежную информацию о присутствии или отсутствии эмбола в ЛА. Более 80% пациентов с клинически существенной ТЭЛА имеют дилатацию ПЖ и недостаточность трехстворчатого клапана .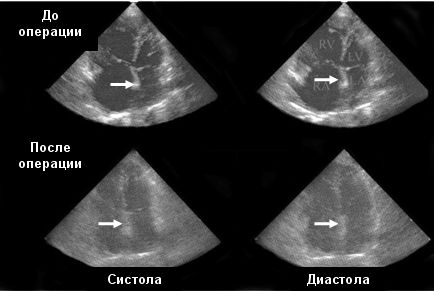
ЭхоКГ до и после операции по поводу ТЭЛА. Межжелудочковая перегородка до операции смещена в сторону левых отделов сердца
Показаниями к легочной эмболэктомии являются тромбоэмболия легочного ствола или главных его ветвей при крайне тяжелой степени нарушения перфузии легких (ангиографический индекс ≥ 27 баллов, перфузионный дефицит 60%), сопровождающейся резко выраженными гемодинамическими расстройствами: стойкой системной гипотензией, либо значительной гипертензией малого круга кровообращения (систолическое давление в правом желудочке ≥ 60 мм рт.ст., конечное диастолическое ≥ 15 мм рт.ст.). Дополнительным основанием к оперативному вмешательству является снижение РаО2 до 55 мм рт.ст. и ниже, РvО2 - до 28 мм рт.ст.
В этих условиях вероятность выздоровления больных при проведении консервативной терапии, включая активаторы фибринолиза, не превышает 12%. В 77% случаев пациенты с такими показателями объема эмболического поражения легочного артериального русла и гемодинамики умирают в острой стадии заболевания. В подобной ситуации компенсаторные возможности организма обычно уже исчерпаны и больные, как правило, не доживают до появления литического эффекта (спонтанного или под влиянием активаторов фибринолиза).
Экстренная легочная тромбэмболэктомия показана больным с опасным для жизни нарушениями гемодинамики, но не должна проводится без точного диагноза. Если пациент был взят в операционную без точного диагноза, транспищеводная ЭхоКГ и допплерография должны быть проведены на операционном столе. Эхокардиография позволяет оценить объем ПЖ, его сократимость, регургитацию на трехстворчатом клапане, которые являются следствием массивной легочной эмболии. ЭхоКГ находки в виде большого тромба в правом предсердии - дополнительное показание к экстренной операции.
Противопоказаниями к легочной эмболэктомии следует считать тяжелые сопутствующие заболевания с неблагоприятным прогнозом – злокачественные новообразования при наличии отдаленных метастазов, выраженная недостаточность кровообращения, вызванная сопутствующими сердечно-сосудистыми заболеваниями, при которых успех операции сомнителен, а риск ее не оправдан. Тяжесть состояния больных, обусловленная предшествующим тяжелым оперативным вмешательством либо самой эмболией, еще не обрекает оперирующего хирурга на неудачу. Описаны случаи успешной легочной эмболэктомии после травматичной гинекологической операции, длительной транспортировки в хирургическую клинику и пятикратной остановки сердца, часового массажа сердца, ранее произведенной эмболэктомии из легочных артерий.
Пожилой возраст больных не является абсолютным противопоказанием к проведению оперативного вмешательства. Известна успешная эмболэктомия у больного 80 лет. В каждом конкретном случае, решая вопрос об эмболэктомии у больных пожилого возраста, необходимо в первую очередь учитывать их общий соматический статус.
В связи с указанными обстоятельствами систолического давление в правом желудочке выше 75 мм рт.ст. должно рассматриваться в качестве относительного противопоказания к экстренной операции. Хирург, который решается в этих условиях на эмболэктомию, должен максимально полно провести освобождение легочного сосудистого русла. Ему следует также быть готовым к тяжелому течению ближайшего послеоперационного периода.
Техника операции
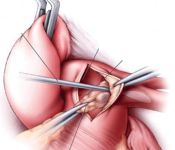
Операция проводится из срединной стернотомии после введения 3 мг/кг гепарина. Аппарат искусственного кровообращения подключается по схеме: полые вены – восходящая аорта. Остановка сердца достигается введением кровяной кардиоплегии с температурой 20-22° С. Глубокая гипотермия не обязательна в связи с коротким сроком оперативного вмешательства. Легочная артерия открывается продольно на 1-2 см выше клапана легочной артерии. Разрез продляется на правую и левую ветви легочной артерии. Тромб тщательно удаляется. Легочная артерия обильно промывается физиологическим раствором с активной аспирацией для удаления мелких фрагментов тромба.
Основной этап операции
Экстракорпоральная перфузия
Современные технологии позволяют использовать новый алгоритм для поддержки больных с массивной легочной эмболией и опасной для жизни гемодинамической неустойчивостью. В тех случаях, когда экстренное хирургическое вмешательство недоступно, а также у больных старческого возраста с необратимым повреждением паренхиматозных органов более приемлемым в настоящее время является использование экстракорпоральной мембранной оксигенации (ЭКМО). Экстракорпоральная перфузия компенсирует гипоксию, и способна поддерживать гемодинамику до лизиса тромба и восстановления адекватной перфузии легких.
ЭКМО в критических ситуациях используется для поддержания жизненно важных функций (адекватной гемодинамики и газообмена) посредством использования аппарата искусственного кровообращения с насыщением крови кислородом через оксигенатор. Подключение достигается посредством канюляции бедренных сосудов (артерии и вены), что может быть выполнено непосредственно в реанимационном отделении под местной анестезией. ЭКМО позволяет восстановить адекватную гемодинамику и газообмен и в последующем выполнить операцию эмболэктомии из легочной артерии. В дальнейшем при нарушении функции газообмена, обусловленным отеком легких, экстракорпоральная перфузия с оксигенацией может быть продлена на 2-3 суток. Во время проведения ЭКМО необходимо поддержание активированного времени свертывания крови - 140-160 сек.
В случае использования экстракорпоральной мембранной оксигенации возможно проведение тромболитической терапии у критических пациентов, однако с повышенным риском кровотечения из мест канюляции бедренных сосудов. Отключение ЭКМО проводится после восстановления нормальной функции газообмена и хорошей гемодинамики.
Послеоперационное ведение
В послеоперационном периоде может наблюдаться реперфузионный отек легких, а также почечная недостаточность и ишемические расстройства, обусловленные постгипоксическим отеком головного мозга. Терапия должна быть направлена на восстановление функции дыхания, почек и ликвидации отека головного мозга. Введение антибиотиков в послеоперационном периоде обязательно для исключения инфекционных осложнений. Большинству пациентов требуется гипервентиляция с небольшим давлением на выдохе (PEEP) – 6 мм рт.ст. Поддержание системного артериального давления больше 80 мм рт.ст. с постепенным снижением дозы адреналина, если сердечный индекс увеличивается больше 3 л/мин/м2. Сохранение небольшого алкалоза (pH = 7,5), снижение давления в легочной артерии и сердечного выброса – это вторичные меры профилактики для развития реперфузионного отека легких и высокого среднего системного артериального давления. Для этого применяются большие дозы диуретиков. У всех пациентов также используется свежезамороженная плазма для поддержания высокого уровня белка в крови.
Результаты
Выживаемость после экстренной легочной тромбоэмболэктомии варьирует в пределах от 40% до 92%. В тех случаях, когда выполнение операции сопровождается проведением закрытого, а в последующем открытого массажа сердца без поддержки экстракорпоральной перфузии, летальность достигает 45-75%. В случаях выполнения операции без остановки сердца летальность колеблется от 8% до 36%. Основными причинами смерти являются ишемическое повреждение мозга, сердечная недостаточность и сепсис. Повторные тромбоэмболии достаточно редки. Около 80% выживших больных в отдаленном послеоперационном периоде имеют нормальное давление в легочной артерии и приемлемую толерантность к физической нагрузке. У 10% в отдаленном послеоперационном периоде сохраняется обструкция около 40-50% легочных сосудов, что значительно снижает функцию легких и толерантность к физической нагрузке.
Хроническая посттромбоэмболическая легочная гипертензия
Хроническая посттромбоэмболическая легочная гипертензия развивается у 0,1-0,5% выживших после тромбоэмболии легочной артерии пациентов.
Патоморфологические изменения
Патоморфологические изменения сводятся к тромбоэмболической окклюзии микрососудистого легочного русла. Легочная биопсия показывает наличие различной степени медиальной гипертрофии и тяжелой эксцентрической энтимальной фиброплазии. Такое эксцентричное развитие фиброзной ткани ассоциируется с плексогемической артериопатией. Появление таких тромботических повреждений приводит к распространению этого процесса от микрососудистого русла к сегментарным и лобулярным артериям чаще, чем развитие эмболии.
Патофизиология
Патофизиология развития легочной гипертензии включает увеличение постнагрузки для правого желудочка вследствие окклюзии легочных артерий и ее ветвей. В основе развития легочной гипертензии лежит снижение комплайнса (податливости) центральных легочных артерий. Комплайнс легочного русла в норме достаточно большой и может увеличиваться в 3-4 раза от состояния покоя. Комплайнс легочного русла кровообращения позволяет в 2-3 раза увеличить объем крови, прежде чем давление в легочной артерии увеличиться вдвое. Тромбоэмболические материалы препятствуют такой нормальной реакции легочного сосудистого русла.
Своевременное хирургическое лечение, освобождающее легочное русло кровообращения от обструктивных материалов позволяет открыть легочные сосуды и вызвать обратное развитие повреждения микроциркуляции.
Диагностика
Диагностика и лечение хронической посттромбоэмболической легочной гипертензии требует специфического подхода, как в плане оценки возможности хирургического вмешательства, так и возможности анестезии и послеоперационного ведения пациентов в отделении интенсивной терапии. При правильном подходе легочная тромбэндартерэктомия может быть осуществлена с приемлемым риском.
Нет никаких абсолютных клинических признаков, характерных для хронической ТЭЛА. Самый общий признак, связанный с легочной гипертензией – одышка. Обмороки или предобморочные состояний - другой общий признак легочной гипертензии. Неопределенные боли груди наблюдаются у 50% пациентов. Периферические отеки появляются при развитии недостаточности ПЖ. Физикальное обследование позволяет выявить яремный венозный пульс. У некоторых пациентов развивается цианоз. Аускультативно над легочной артерией II тон усилен, слышен систолический щелчок изгнания и диастолический шум недостаточности клапана ЛА, а также систолический шум недостаточности трехстворчатого клапана.
Тесты легочной функции показывают минимальные изменения в объеме легких и вентиляции. Пациенты имеют нормальную или немного ограниченную легочную механику. Жизненная емкость легких часто уменьшается и может быть единственным признаком нарушения функции легких. Давление в ЛА увеличено, сердечный выброс снижен. Анализ газов крови выявляют гипоксию (PaO2 53-80 мм рт.ст.), PaCO2 < 35 мм рт.ст.
Чтобы гарантировать точный диагноз у пациентов с хронической ТЭЛА рекомендуется стандартизированная оценка для всех больных с необъяснимой легочной гипертензией. На рентенограмме грудной клетки выявляется увеличение тени ЛА, и снижение интенсивности периферического легочного рисунка, гипертрофия ПЖ .
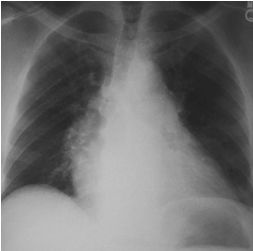
Рентгенограмма грудной клетки больного с легочной гипертензией. Увеличено правое предсердие и обеднен периферический легочный рисунок
На ЭКГ отмечается гипертрофия ПЖ и возможна блокада правой ножки пучка Гиса. Легочная ангиограмма при хронической ТЭЛА отличается от таковой при острой окклюзии, так как не показывает характерных дефектов заполнения легочного сосудистого русла, проявляется необычными дефектами заполнения, сосудистой сети или полосами полностью тромбированных сосудов, напоминающих врожденную патологию. Вследствие утолщения сосудистой стенки, заполненный контрастом просвет может казаться относительно нормальным в диаметре.
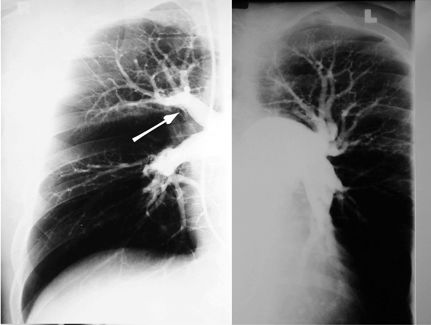
Правая и левая легочная ангиограмма. Увеличение и постстенотическое расширение артерии в диаметре, обеднение легочного кровотока
У 20% пациентов трудно провести дифференциальный диагноз между первичной и посттромбоэмболической легочной гипертензией. В этих случаях показана легочная ангиоскопия с помощью специального катетера с баллоном на конце, обеспечивающего визуальный осмотр. Классическая хроническая ТЭЛА проявляется утолщением интимы и присутствием эмболического материала.
Возможности консервативного лечения постэмболических поражений легочных артерий крайне ограничены. В отличие от сердечной недостаточности иной этиологии, назначение гликозидов при декомпенсированном хроническом сердце эмболического генеза обычно не дает эффекта. Интенсивная медикаментозная терапия, включая кардиотонические средства, салуретики и длительный прием антикоагулянтов также не ведет к выздоровлению, хотя в некоторых случаях помогает добиться некоторой стабилизации процесса.
Легочная тромбэндартерэктомия
Показаниями к легочной тромбэндартерэктомии являются соответствующая симптоматика (функциональный класс NYHA III или IV), а также нарушение гемодинамики (системное легочное сопротивление > 300 ед./сек./см-5) и функции газообмена во время отдыха или при физической нагрузке. У больных со II функциональным классом NYHA и меньшим легочным сопротивлением наиболее приемлемо медикаментозное лечение, особенно в случаях, если поражены сегментарные или субсегментарные артерии. Тромбэндартерэктомия из легочной артерии показана также пациентам, которые имеют нормальную или близкую к нормальной легочную гемодинамику в покое, однако при выполнении физической нагрузки давление в легочной артерии значительно возрастает.
Кроме указанных критериев необходимо оценивать:
• Уровень легочной гипертензии. Данные литературы показывают, что успех операции наиболее вероятен при уровне систолического давления в легочном стволе, не превышающем 90-95 мм рт.ст. С другой стороны, вряд ли оправдан риск тяжелого вмешательства у больных при давлении ниже 50 мм рт.ст., поскольку оно не может обусловить быстрого развития правожелудочковой недостаточности.
• Состояние дистального сосудистого русла легких. Основным критерием возможности выполнения тромбэндартерэктомии является локализация окклюзии легочного русла кровообращения. Успех возможен только при локализации тромбов в главной долевой или проксимальных отделах сегментарных артерий. В тех случаях, когда локализация окклюзирующих поражений легочного русла относится ко вторичным или более мелким артериях, то легочная тромбэндартерэктомия из основных главных сосудов не приводит к снижению давления в легочном русле в послеоперационном периоде. Однако в дооперационном периоде не просто решить вопрос о состоянии сегментарных легочных артерий, расположенных дистальнее зоны окклюзии. Частота форм гипертензии, подлежащих хирургическому лечению, оценивается L. Antebi (1962) в 25-30%. По мнению E. Hurwitt и соавт. (1958), она достигает 50%. Последняя цифра перекликается с результатами патологоанатомических исследований S. Orell (1962), показавшими, что в половине случаев постэмболическая окклюзия локализуется в главных легочных артериях.
• Длительность заболевания. Возможности хирургического вмешательства во многом зависят от длительности нахождения тромбов в легочных артериях. V.Dor и соавт. (1981) полагают, что лучшие результаты могут быть получены при выполнении операции в течение 6-8 недель от момента эмболической окклюзии. Существует и противоположная точка зрения, которая заключается в полном игнорировании этого фактора. Вместе с тем, восстановление проходимости главных легочных магистралей не может привести к выздоровлению, так как продолжительное существование высокой гипертензии малого круга кровообращения приводит к необратимым изменениям всей легочной сосудистой системы, паренхимы легких и миокарда. Такие больные являются кандидатами для трансплантации сердечно-легочного комплекса.
Чем меньше времени прошло с момента эмболии, тем операция технически легче выполнима. Из литературы ясно, что в первые недели и даже месяцы с момента тромбоэмболии процесс спонтанного восстановления проходимости легочного сосудистого русла может продолжаться. В более поздние сроки он идет уже за счет механической фрагментации, ретракции тромба и гуморального лизиса, а также благодаря процессу «органической фрагментации», вызванному прорастанием эндотелиоцитов, лизиса вросшими полимофноядерными лейкоцитами и фиброваскулярной организации.
По мнению V. Door и соавт. (1981), больные, у которых по данным ангиографиического и гемодинамического контроля отсутствует адекватное восстановление легочного кровотока в течение 3-4 недель с момента тромбоэмболии, должны быть оперированы. D. Sabiston и соавт. (1977), R.Symbas (1977), считают 3 месяца предельным сроком, после которого спонтанное или под влиянием медикаментозного лечения восстановление проходимости легочного сосудистого русла невозможно. Следует отметить, что быстрое прогрессирование симптомов сердечно-легочной недостаточности может сделать необходимым оперативное вмешательство еще до наступления этого контрольного срока.
Противопоказания к легочной тромбэндартерэктомии
Противопоказанием к выполнению легочной тромбэндартерэктомии является сопутствующее самостоятельное заболевание легких в виде обструктивного бронхита, старческий возраст, тяжелая правожелудочковая недостаточность.
Коронарная ангиография должна быть проведена пациентам с подозрением на ИБС. При необходимости АКШ выполняется одновременно с тромбэндартерэктомией. Имплантация кавафильтров в нижнюю полую вену, как правило, рекомендуется перед выполнением основной операции.
Легочная тромбэндартерэктомия. Техника операции
Оперативное вмешательство при хронических постэмболических поражениях представляет собой технически гораздо более сложную задачу, чем в острой стадии легочной эмболии. Плотное спаяние тромба с артериальной стенкой значительно удлиняет внутрисосудистый этап операции и в большинстве случаев требует обнажения не только легочного ствола, но также главных легочных артерий и их долевых ветвей. Вторым немаловажным фактором является наличие высокой гипертензии малого круга, какой не бывает в острой стадии заболевания. От этих обстоятельств зависят доступ, используемый во время операции, и условия, в которых она проводится.
Первую успешную легочную тромбэндартерэктомию осуществил Allison через стернотомию с использованием умеренной гипотермии. В 1978 г. Cabrol описал 16 больных после тромбэндартерэктомии. 14 больных из этой серии были оперированы через боковую торакотомию и двое через срединную стернотомию без искусственного кровообращения. Из 14 больных, оперированных в условиях искусственного кровообращения, 12 выжили. Эти операции производились с использованием глубокой гипотермии и временной остановки кровообращения, которая в последующем стала стандартной процедурой.
Под седацией мидазоламом проводится канюляция a.radialis, вен шеи и введение катетера Swan-Ganz в легочную артерию для постоянного контроля давления и сердечного выброса в режиме реального времени. Транспищеводная эхокардиография необходима для выявления открытого овального окна, которое может стать причиной парадоксальной эмболии из правых в левые отделы сердца. Операция выполняется под обезболиванием фентанилом, использованием миорелаксантов, для поддержания адекватной гемодинамики используются различные комбинации вазопрессорных катехоламинов.
Выполняется срединная стернотомия. Для защиты головного мозга может использоваться глубокая гипотермия, а также ретроградная цереброплегия во время полной остановки искусственного кровообращения, которая увеличивает время безопасной ишемии мозга с 15 до 30 минут.
Искусственное кровообращение проводиться в стандартном режиме – 2,4 л/мин/м2 осуществляется посредством подключения по схеме: полые вены – аорта. Пациент охлаждается в течение 30 минут до достижения назофарингеальной температуры 15° С. Остановка сердца достигается анте- ретроградной кровяной кардиоплегией при 28° С. В случаях использования глубокой гипотермии по достижении температуры 15° С, останавливается искусственное кровообращение, начинается ретроградная перфузия головного мозга. Вскрывается продольно ствол легочной артерии с продлением разреза на левую и правую ветви легочной артерии. 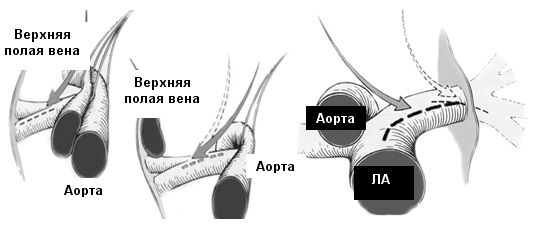
Вскрытие ветвей легочной артерии
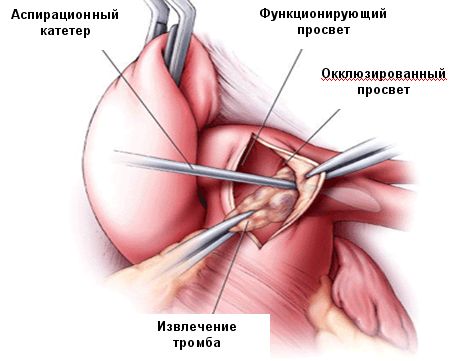
Проводится тщательное отделение эмболов, сросшихся с интимой. Процедура выполняется крайне деликатно для предотвращения повреждения адвентиции, которое, в последующем, может привести к массивному кровотечению. Удаление эмболов проводится, по возможности, до лобарных или сегментарных артерий последовательно из обоих ветвей легочной артерии. Выполняется тщательный дебридмент остатков старых тромбов с помощью отсоса, а также сдавлением легких для освобождения легочных сосудов от остатков детрита.
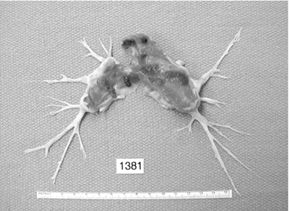
Извлеченный тромбоэмбол
В последующем проводится ушивание артериотомных отверстий одно- или двухрядным швом, согревание занимает от одного до полутора часов. Восстанавливается легочная вентиляция в это время идеальной является постоянная инфузия простагландина-I с дозировкой 0,5-1 ед./мин. После окончания согревания искусственное кровообращение отключается. Правожелудочковая недостаточность не является важной проблемой, если проведена адекватная защита миокарда. Использование добутамина или других катехоламинов проводится в зависимости от необходимости гемодинамической поддержки.
Послеоперационное ведение
Послеоперационное ведение не отличается от обычного ведения раннего послеоперационного периода у пациентов после использования искусственного кровообращения с постоянным контролем параметров гемодинамики, артериального и венозного давления, сатурации кислорода и т.д. Для поддержания гемодинамики возможна комбинация добутамина с фенилэпинефрином в комбинации с простагландинами и допамином. При необходимости используются небольшие дозы амринона или милринона.
При проведении искусственной вентиляции легких на начальном этапе раннего послеоперационного периода используется положительное давление на выдохе (5 мм рт. ст.) и инсуфляция 80-100% кислорода. Большинство больных экстубируется через 16-18 часов. Часть из пациентов в случаях гипоксемии и гидрокарбии требует вентиляционной поддержки в течение 1-2 недель с использованием положительного давления на выдохе.
Для профилактики инфекционных осложнений используется комбинация антибиотиков: цефалоспорина или ванкомицина в течение 3-х дней или во время всего периода искусственной вентиляции. Возобновление введения гепарина начинается после окончания поступления крови по дренажам, достижения частичного тромбопластинового времени 50-60 сек. В послеоперационном периоде рекомендовано применение комбинации непрямых антикоагулянтов (варфарин) с небольшими дозами аспирина (80 мг ежедневно) для поддержания МНО – 2,8-3,5.
Осложнения
Осложнения в послеоперационном периоде не отличаются от осложнений у пациентов, которым параллельно проводилась различная коррекция патологии сердца с использованием искусственного кровообращения. К ним относятся аритмии, ателектазы, раневые инфекции, пневмония или кровотечение.
Реперфузионные повреждения легких у большинства пациентов развиваются вследствие повышенной проницаемости легочного сосудистого русла для активированных нитрофилов. Они проявляется в первые 24 часа после выполнения операции и характеризуется артериальной гипоксемией, что рентгенологически проявляется инфильтратами в области сегментов легких, подвергшихся тромбэндартерэктомии. Тяжесть реперфузионных повреждений варьирует от средних форм, проявляющихся в послеоперационном периоде гипоксимией до реперфузионного отека легких, который может развиться в течение первых 2-3 дней после операции. Реперфузионный отек легких увеличивает физиологический шунт более чем на 30%, повышая необходимость в достижении высокого давления кислорода и снижения легочного комплайнса. Этот процесс также уменьшает количество легочного сурфактанта, приводит к ателектазам, с последующим развитием пневмонии. Реперфузионный отек легких очень похож на острый респираторный дистресс-синдром и должен лечиться агрессивным введением диуретиков, вентиляционной поддержкой с режимом положительного давления на выдохе, профилактикой инфекции в течение всего послеоперационного периода. Для коррекции возникших нарушений, как правило, назначается NO, который улучшает газообмен, однако не снижает необходимости вентиляционной поддержки и не увеличивает выживаемость. Наиболее оптимальным способом лечения является использование ЭКМО.
Злокачественная легочная артериальная гипертензия (спазм сосудов), в основном, должна контролироваться профилактическим назначением протагландина-I. Несмотря на то, что после окончания искусственного кровообращения у таких пациентов давление в легочной артерии составляет 50-60% системного и сравнимо с тем, что было до операции, в течение нескольких дней легочное давление значительно повышается, несмотря на использование нитроглицерина, гипокарбии, антихолиноэстеразных ингибиторов, добутамина, изопротеренола. Если не удается добиться снижения констрикции легочных артерий у этих больных развивается тяжелая правожелудочковая недостаточность. Механизм развития злокачественной легочной гипертензии не известен. K.M. Moser et al.(1985) считает, что этот феномен является «vascular steal» - «сосудистой кражей» и обусловлен гиперперфузией вследствие открытия легочного сосудистого русла после тромбэктомии. Несмотря на то, что в последнее время используется NO, способный снижать послеоперационное давление в легочной артерии с одновременным улучшением оксигенации, этого бывает недостаточно.
Остаточная легочная гипертензия после тромбэндартерэктомии, как правило, обусловлена невозможностью полного удаления эмболов из мелких артерий. Она сопровождается правожелудочковой недостаточностью. Основными направлениями в лечении являются снижение потребления кислорода, увеличение преднагрузки правого желудочка и агрессивная инотропная поддержка. Использование NO может улучшить газообмен у пациентов с тяжелыми реперфузионными повреждениями, но, как уже было сказано, не уменьшает необходимости в вентиляционной поддержке и не увеличивает выживаемость.
Неврологические осложнения, в основном, связаны с использованием глубокой гипотермии и обычно нивелируются в течение 2-3 дней после операции. Более тяжелые неврологические нарушения связаны с продленной остановкой кровообращения (больше 60 минут). [Fedullo P.F., Rubin L.J., Kerr K.M. et al., 2000].
Результаты. К 2003 году были описаны приблизительно около 4000 тромбэндартерэктомий из легочной артерии, из них 1500 выполнены в одном центре. Госпитальная (30-дневная летальность) составляет от 5,4% до 27%. До 1990 года она была на уровне 12,6-37,5%, но с накоплением опыта в последующие годы летальность значительно снизилась и с 1996 года составляла в различных центрах от 5 до 24%.
Одним из основных факторов риска является высокое легочное сопротивление больше 1100 ед./сек.cм-5 и послеоперационная длительность ИВЛ больше 5 дней, частично - продленное время искусственного кровообращения. По данным различных исследователей тяжелое поражение легочной артерии со средним давлением больше 50 мм рт.ст. легочного столба и средним легочным сопротивлением > 1100 ед./сек.см-5 сопровождается значительно большей летальностью 37% против 8%, если эти цифры значительно ниже.
Летальность, в основном, обусловлена высоким общим риском операции на открытом сердце. Основными причинами смерти после благополучно проведенной операции являются развитие злокачественной легочной гипертензии, правожелудочковая недостаточность, перфузионные повреждениями легких, резидуальная легочная гипертензия, кровотечение и другие осложнения, связанные с неврологическими нарушениями и правожелудочковой недостаточностью.
Улучшение давления наполнения правого желудочка и снижение давления в легочной артерии происходит в течение ближайших дней и достигает 50-60% от предоперационного уровня и приближается к нормальному. Легочное сопротивление, в среднем, снижается с 900 до 260 ед./сек.cм-5, а сердечный выброс увеличивается с 3,7 до 5,7 л/мин. Недостаточность трехстворчатого клапана уменьшается или исчезает.
В раннем послеоперационном периоде наблюдается снижение легочного сопротивления приблизительно у 65% больных. Параллельно с этим наблюдается улучшение газообмена и толерантности к физической нагрузке. Большинство больных, находящихся в III и IV функциональном классе NYHA перед операцией, после операции имеет I-II функциональный класс NYHA.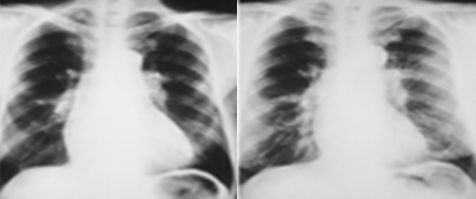
Рентгенограммы до- и после легочной тромбэндартерэктомии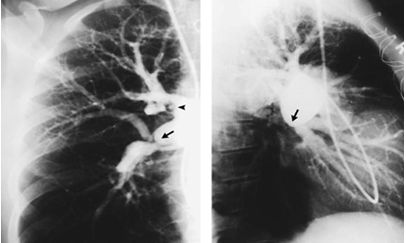
Ангиограммы до- и после проведения легочной тромбэндартерэктомии
Отдаленные результаты
76% пациентов после операции находятся в I функциональном классе NYHA, остальные 24% - во II. В отдаленном послеоперационном периоде редко отмечается гипоксемия. Значительно снижается легочное сопротивление, увеличивается сердечный выброс.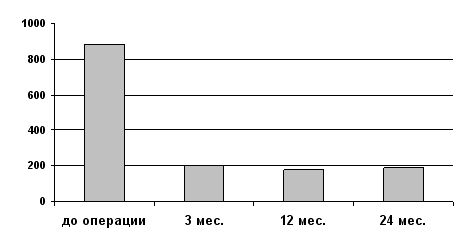
Динамика легочного сопротивления ( ед./сек./cм-5)
При адекватной антикоагулянтной терапии повторные эмболии легочной артерии достаточно редки. Иногда наблюдается правожелудочковая недостаточность, связанная в основном со вторичным изменением микроциркуляторного легочного кровеносного русла.
Продолжительная антикоагулянтая терапия абсолютно рекомендована пациентам после тромбэндартерэктомии. Для достижения терапевтического эффекта, предотвращающего тромбозы и повторные тромбоэмболии в легочную артерию, необходимо поддерживать адекватный уровень МНО (2-2,5). Пациенты, которым выполнение адекватной тромбэндартерэктомии не возможно, являются кандидатами для трансплантации сердца.
Становиться все более очевидным, что легочная гипертензия, вызванная хронической легочной эмболией, не подлежит медикаментозному лечению. Единственной альтернативой легочной тромбэмболэктомии является трансплантация легких. Преимущества тромбэмболэктомии включают более низкую госпитальную смертность и хорошие отдаленные результаты без риска, связанного с хронической иммунодепрессией и отторжением аллотрансплантата. Дальнейший прогресс хирургического лечения должен помочь большему количеству пациентов с этой, в конечном счете, фатальной болезнью.
Профессор, доктор медицинских наук Ю.П. Островский


