
По данным рабочей группы экспертов ВОЗ, диагноз идиопатической ДКМП можно установить только после исключения специфических КМП. На основании только клинического обследования нельзя исключить существование таких специфических КМП, как воспалительная, ишемическая или алкогольная, а также КМП, ассоциированных с метаболическими нарушениями.
Распространенность ДКМП
Дилатационная кардиомиопатия - хроническое поражение миокарда, характеризующееся дилатацией полостей сердца и нарушением систолической функции левого или обоих желудочков. ДКМП диагностируют при отсутствии системной артериальной гипертензии или клапанных пороков сердца, ранее перенесенного инфаркта миокарда, хронической ишемии миокарда или устойчивых нарушений ритма. Заболеваемость ДКМП в общей популяции населения США составляет 36 человек на 100 тыс. населения в год.
Диагностические критерии дилатационной кардиомиопатии
| 1. Снижение ФВ ЛЖ ‹0,45 (>2SD) и (или) фракции укорочения ‹25% (>2SD), диагностированное по результатам ЭхоКГ, радионуклидного исследования или ангиографии |
| 2. КДР ЛЖ >117% прогнозируемого значения с поправкой на возраст и площадь поверхности тела, который соответствует 2SD вычисленных нормальных размеров +5% |
| Критерии исключения, которые могут характеризовать фенокопии |
| Системная артериальная гипертензия (>160/100 мм рт.ст.), документированная и подтвержденная повторяемостью измерений, с поражением органов-мишеней или без него |
| ИБС (обструкция >50% диаметра главных ветвей венечных артерий) |
| Частые алкогольные эксцессы в анамнезе с последующим исчезновением симптомов СН после 6 мес алкогольного воздержания |
| Устойчивые наджелудочковые тахиаритмии, сопровождающиеся клиническими симптомами |
| Системные заболевания |
| Болезни перикарда |
| Врожденные пороки сердца |
| Легочное сердце |
Причины возникновения дилатационной кардиомиопатии (ДКМП)
Долгое время причины возникновения идиопатической (спорадической) формы ДКМП оставались неизвестными. Согласно современным представлениям, по меньшей мере в 30-40% случаев заболевание наследуется. Другие важные факторы патогенеза заболевания - плохое питание (недоедание), дефицит тиамина и белка в организме, а также действие на миокард антрациклиновых производных, например доксорубицина. По всей вероятности, большинство вторичных форм ДКМП, в частности алкогольная, гипертензивная или ишемическая КМП, возникает в тех случаях, когда на фоне генетической предрасположенности к заболеванию повышается гемодинамическая нагрузка на сердечно-сосудистую систему (например, во время беременности) или возникают факторы, оказывающие прямое повреждающее действие на миокард (например, этиловый спирт).
Распространенность семейной формы ДКМП долгое время недооценивали. Это связано с тем, что признаки заболевания у членов одной семьи часто манифестировали не в полном объеме. В частности, при проспективном наблюдении за асимптомными родственниками больных ДКМП в 20% случаев обнаружено изолированное расширение левого желудочка, в 6% случаев - незначительное снижение сократительной способности миокарда и в 3% случаев - истинная ДКМП. Кроме того, отсутствие клинических признаков заболевания у родственников больных ДКМП при изолированном расширении ЛЖ сопровождалось типичными для этого нарушения гистологическими и иммунобиохимическими изменениями, аналогичными тем, которые возникают при ДКМП, включая полиморфизм кардиомиоцитов, интерстициальный фиброз, а также присутствие неспецифических маркеров иммунологической активности. У части родственников, у которых в процессе обследования были обнаружены незначительные изменения со стороны сердца, со временем развивалась выраженная ДКМП. Этот факт подчеркивает диагностическую значимость минимальных клинических изменений как маркеров ранней стадии заболевания. Таким образом, при установлении диагноза недостаточно данных только семейного анамнеза; для диагностики семейных случаев заболевания оправдано обследование близких родственников.
Другая проблема состоит в вариабельности фенотипических признаков семейной формы дилатационной кардиомиопатии, среди которых можно выделить нарушения ритма, инсульт, нарушения проводимости и ВСС в сочетании с дилатацией и дисфункцией желудочков. Поскольку наиболее частый тип наследования ДКМП - аутосомно-доминантный, у родственников первой линии существует высокая вероятность (50%) существования генетического дефекта. Кроме того, у них высока вероятность того, что слабовыраженные и необъяснимые нарушения со стороны сердца служат клиническими признаками ДКМП. Для диагностики семейной формы ДКМП были предложены специальные критерии. Дополнительное препятствие в диагностике семейных форм ДКМП - широкая вариабельность клинических симптомов заболевания в зависимости от возраста. По данным одного из итальянских исследований, вероятность развития ДКМП у лиц в возрасте до 20 лет составляет 10%, 20-30 лет - 34%, 30-40 лет - 60%, а в возрасте старше 40 лет - 90%. Кроме того, изучение семейных форм ДКМП затруднено не только в связи с малочисленностью семей больных с указанным заболеванием, но и с необходимостью проспективного наблюдения за их членами в течение длительного периода времени.
В тех случаях, когда указание на семейный анамнез отсутствует, ДКМП может развиваться в результате перенесенного острого миокардита. Была предложена трехфазная модель развития заболевания, когда сначала поражается миокард, а затем развивается хроническое воспаление, которое, в свою очередь, приводит к ремоделированию сердца и его дисфункции. Считают, что первичное поражение миокарда развивается в результате вирусной инфекции, чаще всего - энтеро- или аденовирусной. Несмотря на то что в отдельных случаях (преимущественно у детей) острый вирусный миокардит может привести к летальному исходу, большинство больных выздоравливают без каких-либо последствий. В некоторых случаях вследствие персистенции вируса или аутоимунной реакции развивается хроническое воспаление. При исследовании эндомиокардиального биоптата в этом случае обнаруживают лимфоцитарную инфильтрацию, а также определяют гистологические маркеры иммунологической активности. Кроме того, у 35% больных ДКМП с помощью полимеразной цепной реакции (ПЦР) обнаруживают вирусный геном в миокарде. У большинства больных миокардитом (в острой стадии или стадии заживления), а также у пациентов с ДКМП в ткани миокарда с помощью иммуногистохимических методов обнаруживают белок VP1 оболочки энтеровируса, присутствие которого свидетельствует о процессе трансляции вирусного эпитопа. Это подтверждает роль латентной вирусной инфекции в патогенезе ДКМП. У некоторых пациентов с ЛЖ-СН и персистирующей вирусной инфекцией применение интерферона бета-1b в течение 6 мес приводило не только к гибели вируса, но и к улучшению функции ЛЖ. Тем не менее причинно-следственная связь между обнаружением вируса и развитием ДКМП не доказана. В частности, продемонстрировано присутствие энтеровируса в миокарде больных ИБС.
При аутоиммунной модели развития ДКМП центральную роль в поражении миокарда отводят иммунной системе. При первичном контакте с вирусом полноценный иммунный ответ имеет решающее значение в предупреждении развития фульминантного миокардита. Обнаружение такого маркера активации иммунной системы, как антимиокардиальный IgG, свидетельствует о благоприятном исходе вирусной инфекции. К сожалению, вирусное повреждение тканей может повлечь за собой презентацию измененных белков миокарда иммунной системе. Развитию органоспецифичных аутоиммунных реакций способствует и молекулярная мимикрия - феномен, обусловленный сходством между вирусными белками и эндогенными антигенами миокарда. Третий потенциальный механизм повреждения миокарда при вирусной инфекции связан с вирусиндуцированной экспрессией молекул главного комплекса гистосовместимости класса II в тканях сердца, в результате чего происходит презентация собственных белков Т-лимфоцитам и активация органоспецифического иммунитета. При исследовании эндомиокардиальных биоптатов больных ДКМП была обнаружена экспрессия молекул главного комплекса гистосовместимости класса II в эндокардиальных и эндотелиальных клетках. Аутоиммунная теория подтверждается обнаружением у 25-30% больных ДКМП и их бессимптомных родственников циркулирующих антител к миокарду. Следует отметить, что последние часто присутствовали у тех родственников больных ДКМП, у которых в дальнейшем заболевание прогрессировало. Как показало дальнейшее наблюдение, при развитии выраженных клинических признаков ДКМП антитела к миокарду в большинстве случаев уже не определялись. Именно поэтому возможность их использования в качестве ранних маркеров заболевания остается дискутабельной. Проведение иммуносупрессивной терапии глюкокортикоидами и азатиоприном в течение 3 мес приводило к раннему и стойкому улучшению функции ЛЖ у больных ДКМП, у которых по результатам биопсии существовала экспрессия несоответствующего класса (т.е. II) молекул главного комплекса гистосовместимости
.
Следует отметить, что в подавляющем большинстве семейных форм ДКМП генетические нарушения сочетаются с аутоиммунными, поскольку сродство к определенным аллелям молекул главного комплекса гистосовместимости у аутоантигенов выше, чем у аллоантигенов. Например, аллель HLA-DR4 предрасполагает к развитию аутоиммунных заболеваний, таких как ревматоидный артрит и рассеянный склероз, но слабо связана с ДКМП. Аналогично этому, в качестве пускового фактора развития ДКМП у лиц с генетической предрасположенностью могут действовать вирусы. Отсутствие вирусного генома в миокарде больных семейной формой ДКМП противоречит этому предположению, подтверждая тот факт, что вирусная ДКМП и семейная ДКМП - разные формы заболевания. Кроме того, во многих семьях больных ДКМП заболевание связано с мутацией одного гена. Именно поэтому обнаружение мутаций, связанных с развитием заболевания, может способствовать пониманию его патогенеза. При ДКМП преобладает аутосомно-доминантный тип наследования, хотя признано существование рецессивных, митохондриальных и Х-сцепленных форм заболевания.
Генетика
Исследование этиологии ДКМП на молекулярном уровне оказалось достаточно сложной проблемой в связи с генетической гетерогенностью популяции больных. Одним из первых крупных успехов было обнаружение гена, кодирующего белок дистрофин, мутация которого приводит к развитию семейной формы ДКМП. Его наследование сцеплено с хромосомой Х. Мутацию гена дистрофина также регистрируют при миодистрофиях Дюшенна и Беккера. Несмотря на то что у пациентов с миодистрофией часто развивается ДКМП, у больных с семейной формой заболевания, сцепленной с хромосомой Х, поражение скелетной мускулатуры обнаруживают достаточно редко, хотя активность мышечной изоформы КФК в крови повышается в обоих случаях.
Фибриллярный белок дистрофин (молекулярная масса дистрофина человека - 427 кД) располагается на внутренней поверхности цитоплазматической мембраны миоцита (сарколеммы). Считают, что его большой размер предрасполагает к высокой частоте возникновения спонтанных мутаций. Своим N-концом дистрофин связывает актин, а С-концом прикрепляется к трансмембранному дистрофингликопротеиновому комплексу, тем самым обеспечивая связь между цитоскелетом и сарколеммой. При ДКМП большинство Х-сцепленных генов дистрофина и мутаций поражают участок гена, кодирующий N-концевой домен.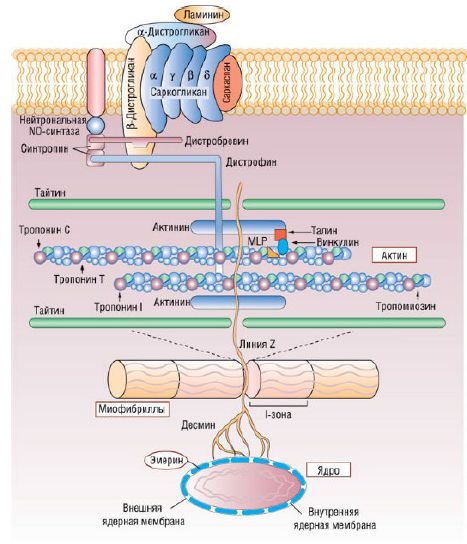
Белки кардиомиоцитов и пути их вовлечения в патогенез кардиомиопатии: MLP - мышечный белок семейства LIM-белков
Первым геном, ответственным за развитие ДКМП с аутосомно-доминантным типом наследования, был ген, расположенный в хромосоме 15q14 и кодирующий мышечный сократительный белок сердечный актин. Он является основным компонентом тонких филаментов саркомеров кардиомиоцитов, выполняя двойную функцию: взаимодействует с другими компонентами саркомера (тяжелыми цепями β-миозина, α-тропомиозином, тропонинами) и играет ключевую роль в процессе сокращения. Кроме того, актин связывается с такими якорными белками, как дистрофин и α-актинин, которые находятся в Z-дисках и вставочных дисках саркомера. Благодаря этому взаимодействию облегчается передача силы сокращения на сарколемму и прилегающие к ней кардиомиоциты. Мутация участка гена, кодирующего саркомерный конец актина, ассоциирована с развитием ГКМП, в то время как дефект участка гена, кодирующего якорный конец актина, служит причиной возникновения ДКМП. Мутация актина при ДКМП приводит к нарушению передачи силы сокращения на сарколемму. Аналогичным образом возникают мутации α-тропомиозина, также приводящие к развитию ДКМП. В результате происходит изменение локального заряда на поверхности белка тропомиозина, что может влиять на стабильность молекулы тропомиозина и нарушить ее электростатическое взаимодействие с актином в тонких миофиламентах. В связи с этим тонкий миофиламент не может полноценно участвовать в передаче сокращения на соседние саркомеры. Напротив, некоторые мутации тропомиозина, обнаруживаемые при ГКМП, приводят не к снижению, а к увеличению силы изометрического сокращения. В результате подобных изменений происходит нарушение метаболизма АТФ в кардиомиоцитах.
При обследовании семей больных ДКМП была обнаружена миссенс-мутация в гене, кодирующем промежуточный миофиламент десмин. Связь десмина, актина и дистрофина с развитием ДКМП наводит на мысль о том, что нарушение функции цитоскелетных белков - ключевое звено патогенеза заболевания. Подтверждением этому факту служат мутации генов дистрофин-глико-протеинового комплекса (σ-саркогликана, β-сарко-гликана), Cypher/Zasp, Z-диска, который присоединяет саркомерные белки к цитоскелету, и метавинкулина, который соединяет актиновые миофиламенты с вставочными дисками. Некоторые из вышеперечисленных мутаций также возможны и при миопатиях, клинические признаки которых варьируют от субклинических до тяжелых.
Мутации генов, кодирующих саркомерные белки, такие как тяжелые цепи β-миозина, сердечный тропонин Т и тропонин С, также могут приводить к развитию ДКМП. Рецессивную миссенс-мутацию гена тропонина I можно обнаружить при семейной форме ДКМП. Для многих семей с ДКМП, развившейся в результате мутации генов белков саркомера, характерен ранний дебют заболевания и неблагоприятный прогноз. Подтверждение роли мутации генов саркомерных белков в патогенезе ДКМП обозначило две серьезные проблемы. Во-первых, остается неясным механизм, с помощью которого осуществляется трансформация генных мутаций в процессы дилатации желудочков, а также то, что функциональные нарушения, возникающие на этом фоне, не всегда можно объяснить дефектом передачи мышечного сокращения. Во-вторых, должно быть найдено объяснение тому, почему определенные мутации генов белков саркомера вызывают развитие ДКМП, в то время как другие дефекты в тех же генах приводят к возникновению фенотипа ГКМП. Было высказано предположение, что мутации, связанные с развитием ДКМП, могут приводить к нарушению образования и проведения мышечного сокращения. И наоборот, мутации генов саркомерных белков, вызывающие развитие ГКМП, способны потенцировать сократительную способность за счет неэффективного использования АТФ, что, в свою очередь, приводит к ремоделированию желудочков, т.е. к гипертрофии.
Нарушение генерации и передачи мышечного сокращения - ключевые моменты, лежащие в основе клинической картины ДКМП. К этим же нарушениям приводят и мутации гена, кодирующего тайтин, - гигантский саркомерный белок, причастный к развитию ДКМП с аутосомно-доминантным типом наследования. Тайтин связывается с α-актинином, стабилизирует миозиновые филаменты и придает эластичность саркомеру. Локализация мутации, вероятно, служит определяющим фактором, влияющим на тип возникновения функциональных нарушений.
Несмотря на многообразие молекулярных механизмов развития ДКМП, последствия на клеточном уровне достаточно схожи: нейроэндокринная активация и локальная продукция цитокинов, гипертрофия кардиомиоцитов, апоптоз, фиброз, а также нарастающая дилатация полостей желудочков и нарушение их функции. Эти данные подтверждают предположение о едином пути реализации патологического процесса, вызванного мутациями различных генов. Последние исследования показали, что в обоих случаях - и при ДКМП, и при СН ишемической этиологии, присутствует нарушение строения N-концевого фрагмента белка дистрофина, на основании чего было высказано преположение, что утрата структурной целостности цитоскелета кардиомиоцитов может быть центральным звеном развития их дисфункции при сердечной недостаточности. Следует отметить, что структурные изменения дистрофина могут быть обратимыми, например в случае использования искусственного ЛЖ. Это доказывает, что уменьшение механической нагрузки на миокард имеет решающее значение для восстановления жизнеспособности клеток и функций сердца в целом.
Клиническая картина. Течение заболевания
Клиническое течение ДКМП отличается значительной вариабельностью. У большинства больных заболевание протекает достаточно доброкачественно. Прогноз, как при семейной форме, так и в случае спорадической ДКМП, в целом одинаков, и значительно улучшился за последнее десятилетие, в связи с возникновением возможности проведения оптимального лечения, включающего прием иАПФ и β-адреноблокаторов. Вместе с тем пациентов с ДКМП в соответствии с типом прогрессирования заболевания можно условно разделить на две группы:
• пациенты с более благоприятным исходом (группа 1);
• пациенты с быстропрогрессирующим заболеванием, высоким показателем смертности и показаниями к трансплантации сердца в экстренном порядке (группа 2).
Наиболее благоприятный исход при ДКМП ассоциирован с улучшением функции ЛЖ в процессе лечения, сокращением продолжительности существования клинических симптомов, более молодым возрастом, высоким классом ХСН (NYHA), а также с указанием на артериальную гипертензию в анамнезе.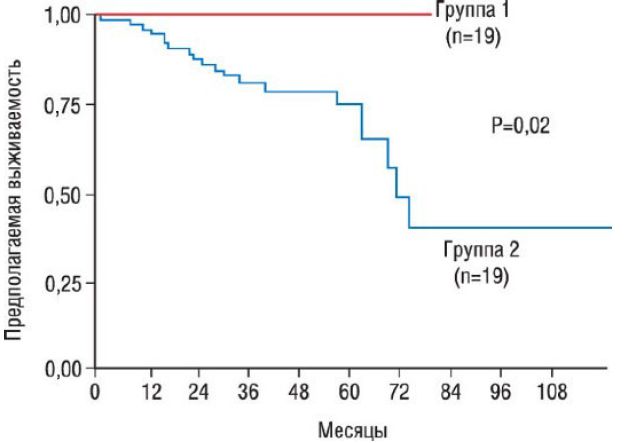
Кривые выживаемости Каплана-Майера двух групп пациентов с дилатационной кардиомиопатией: группа 1 - увеличение ФВ ЛЖ на фоне медикаментозного лечения; группа 2 - изменения ФВ ЛЖ на фоне лечения нет. Вероятность выживания значительно различается (p=0,02).
В процессе лечения иАПФ и (или) β-адреноблокаторами у пациентов с ДКМП в 50% случаев происходит улучшение насосной функции ЛЖ, а ее нормализация - в 16% случаев. Тем не менее у оставшихся 33% больных регистрируют прогрессирование заболевания независимо от того, каков был первичный ответ на лечение. В среднем у 20% больных ДКМП отмечают летальный исход в течение первого года после установления диагноза. Его основная причина в 64% случаев - ВСС. Второе место среди причин смертности занимает терминальная стадия СН. В течение восьми лет среди пациентов с ДКМП без трансплантации сердца выжили:
• 94% больных с восстановившейся до нормальных значений ФВ ЛЖ;
• 83% больных с СН I-II функционального класса по NYHA и ФВ ЛЖ >40%;
• 64% больных с СН I-II функционального класса по NYHA в сочетании с ФВ ЛЖ ≤40%;
• 31% больных с СН III-IV функционального класса по NYHA.
Клиническая картина. Основные симптомы
Клинические симптомы у пациентов с ДКМП не отличаются от таковых у больных с СН другой этиологии. Часто пациенты с ДКМП имеют меньшую выраженность клинических признаков и демонстрируют достаточно высокую переносимость физических нагрузок по сравнению с пациентами, страдающими другими формами КМП. По данным Фремингемского исследования, в зависимости от частоты распространенности клинических симптомов у пациентов с ДКМП или систолической дисфункцией другой этиологии были выделены две группы диагностических критериев: большие (специфические) и малые (неспецифические).
Клинические симптомы у пациентов с хронической сердечной недостаточностью: частота встречаемости больших и малых критериев
| Большие критерии | |
|---|---|
| Хрипы в легких | 81% |
| Кардиомегалия | 70% |
| Повышенное центральное венозное давление | 55% |
| Рентгенологические признаки застоя | 48% |
| Пароксизмальная ночная одышка | 32% |
| Ортопноэ | 31% |
| III тон при аускультации | 19% |
| Малые критерии | |
| Одышка при физической нагрузке | 93% |
| Периферические отеки | 56% |
| Депрессия | 46% |
| Плевральный выпот | 32% |
| Гепатомегалия | 14% |
| Ночной кашель | 12% |
| ЧСС более 120 в минуту | 4% |
| Потеря массы тела менее 4,5 кг в течение 6 мес | 2% |
Для начала лечения СН и определения прогноза при ДКМП достаточно результатов физикального обследования и данных истории болезни, что бесспорно экономически оправдано. На фоне эффективного лечения у многих пациентов с систолической дисфункцией ЛЖ клинические признаки заболевания отсутствуют вовсе или выражены в минимальной степени. Несмотря на это, существование печеночно-яремного рефлюкса (симптом Пастера-Рудо), а также III тона при аускультации сердца дают представление о прогнозе у конкретного пациента в большей степени, чем современные методы обследования.
Патофизиология
В настоящее время известны следующие факторы риска развития ДКМП: артериальная гипертензия, наследственная предрасположенность, миокардит вирусного или токсического происхождения, тахиаритмии и патологический иммунный ответ. Последний вследствие нейрогуморальной активации усиливает напряжение стенки миокарда и служит причиной возникновения патологических изменений в его структуре на клеточном и молекулярном уровне, что способствует ремоделированию миокарда. С точки зрения гистологии ремоделирование ассоциировано с гипертрофией кардиомиоцитов, которая сопровождается изменением качественного и количественного состава стромы миокарда. На биохимическом уровне происходит уменьшение экспрессии генов взрослого организма за счет активации фетальной генной программы. В результате этого количество жизнеспособных, функционально активных кардиомиоцитов уменьшается вследствие запуска программированной клеточной гибели - апоптоза. Индукторы апоптоза кардиомиоцитов in vitro:
• катехоламины (посредством β-адренергического действия и активных форм кислорода);
• напряжение стенки миокарда и ангиотензин II ;
• оксид азота и провоспалительные цитокины.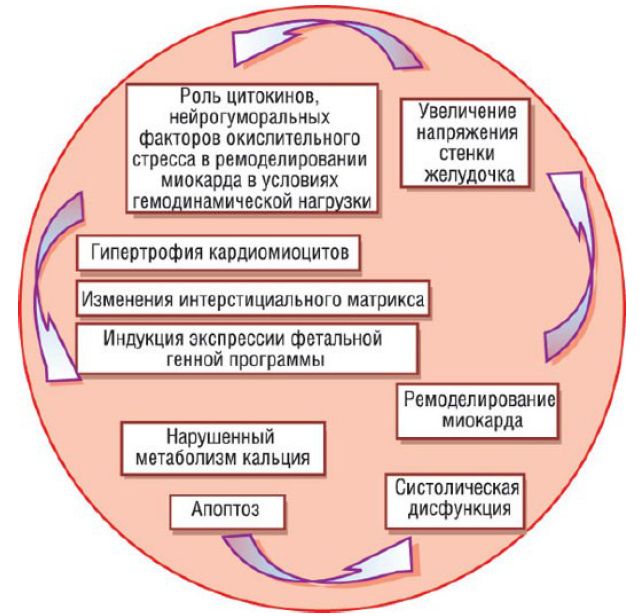
Порочный круг развития систолической дисфункции: различные факторы вызывают комплекс клеточных изменений, что, в конечном итоге, приводит к развитию систолической и (или) диастолической дисфункции и увеличению гемодинамической нагрузки на миокард, способствующей патологическому ремоделированию.
Неудивительно, что почти все ЛС, применяемые для лечения СН, оказывают антагонистическое действие на эти звенья патогенеза. Они снижают и, возможно, прекращают патологическое ремоделирование миокарда, блокируя пути его реализации и тем самым повышая выживаемость больных.
Симпатоадреналовая система
Длительное повышение симпатической активности приводит к десенситизации и уменьшению плотности β-адренорецепторов сарколеммы кардиомиоцитов. Причина их десенситизации - повышенная экспрессия киназы β-адренер-гических рецепторов в пораженном миокарде. Этот фермент осуществляет фосфорилирование β-адрено-рецепторов. Фосфорилированные β-адрено-рецепторы в дальнейшем усваиваются поврежденным кардиомиоцитом и разрушаются в его протеосомах [78]. На примере трансгенных доминантно-негативных MLP-мышиных моделей СН экспрессия мутантной доми-нантно-негативной киназы β-адренергических рецепторов восстанавливает сигнальный путь, связанный с β-адрено-рецепторами, и предупреждает прогрессирование СН. Эти данные свидетельствуют о том, что нарушение передачи сигнала с β-адрено-рецепторов - ключевой механизм развития СН, но пути реализации эффектов с β-адрено-рецепторов, способствующих развитию СН, по-прежнему остаются неясными.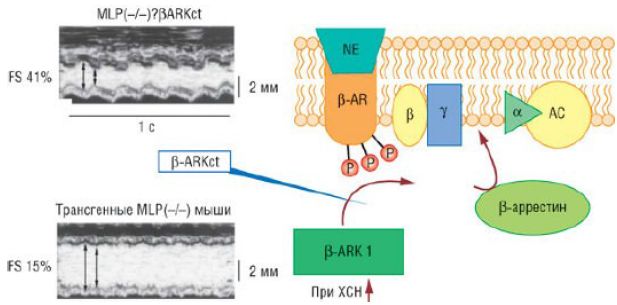
Пути передачи сигнала через β-адренорецепторы (βАR) при сердечной недостаточности: β1-адренорецепторы (βАRK1) связываются с βγ-субъединицами активированных G-белков, перемещаются в мембрану сарколеммы и фосфорилируют агонистсвязанные рецепторы. Фосфорилирование позволяет связать β-аррестин, что защищает рецепторы от дальнейшей стимуляции G-белка и других эффекторов, таких как аденилатциклазы (АС). β1-Адренорецепторы и β-аррестин необходимы для гомологичной десенсибилизации β-адренорецепторов - явления, которое происходит после длительной стимуляции агонистами рецепторов [норадреналин (NE)], что характерно для ХСН. Экспрессия C-терминального, измененного β1-адренорецептора у трансгенных мышей, негативных по MLP, защищает миокард и восстанавливает β-адренорецепторное реагирование. ХСН - хроническая сердечная недостаточность; FS - фракция укорочения; MLP(-/)?βАRKct - трансгенные MLP(-/) мыши с повышенной экспрессией пептидного ингибитора киназы β-адренорецептора.
Гомеостаз кальция
Нарушения обмена кальция играют немаловажную роль в формировании систолической дисфункции ЛЖ при ДКМП. Ионы кальция проникают внутрь клеток через специфические каналы L-типа во время каждого сердечного сокращения и вызывают высвобождение кальция путем активации рианодиновых рецепторов. Это приводит к повышению концентрации внутриклеточного кальция примерно в 10 раз. Обратный захват кальция в фазе сердечного расслабления саркоплазматический ретикулум осуществляет с помощью Са2+-АТФазы. Ее способность перекачивать кальций обратно в саркоплазматический ретикулум регулирует фосфоламбан - небольшой модуляторный белок, расположенный в мембране саркоплазматического ретикулума. При СН высвобождение и захват кальция снижается в связи с уменьшением экспрессии и активности Са2+-АТФазы, в результате чего развивается диастолическая и систолическая дисфункция. Предположение о том, что нарушение транспорта кальция приводит к развитию систолической дисфункции при ДКМП, основано на результатах исследования in vivo. Мыши, лишенные сердечного LIM-домена (цинксодержащих фрагментов Lin1, Isl-1 и Mec-3 белка MLP, играющего важную роль в организации цитоскелета кардиомиоцита) и имеющие клинические признаки СН, полностью меняли свой фенотип в случае гомозиготной делеции гена, кодирующего фосфоламбан, который потенцирует обратный захват кальция саркоплазматическим ретикулумом. Подобный эффект продемонстрирован только на мышиных моделях ДКМП и СН, тогда как на других моделях инактивация фосфоламбана не приводила к предупреждению развития КМП, обусловленной патологическими изменениями саркомера.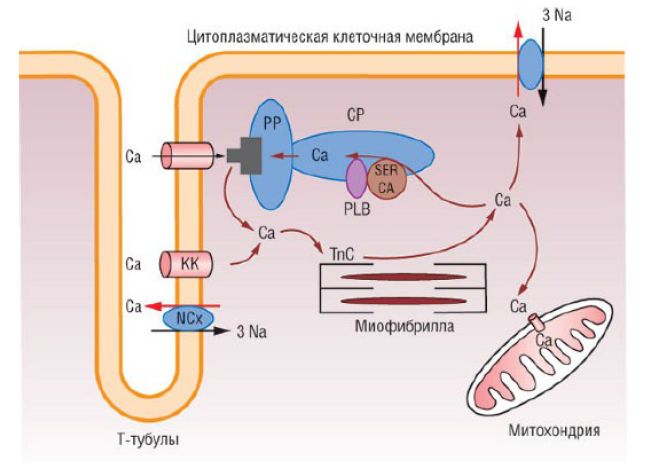
Гомеостаз кальция: при деполяризации мембраны открываются активированные кальциевые каналы L-типа (КК), ионы внеклеточного Са2+ поступают в кардиомиоциты и вызывают освобождение Са2+ через рианодиновые рецепторы (РР). Концентрация Са2+ в цитоплазме кардиомиоцита увеличивается и вызывает сокращение. В саркоплазматическом ретикулуме (СР) с участием саркоплазматической Са2+-АТФазы (SERCA) происходит АТФ-зависимый обратный захват ионов кальция или перемещение его с помощью натрий-кальциевого обмена (NCx), в результате чего концентрация цитозольного Са2+ снижается и сокращение прекращается. PLB - фосфоласибан; Tnc - тропонин.
Натрийуретический пептид
СН при ДКМП сопровождается активацией синтеза и секреции предсердного и мозгового натрийуретического пептида в сердце, который опосредованно через специфические рецепторы взаимодействует с гуанилатциклазой. В результате происходит активация протеинкиназы G через цГМФ. Показано, что благодаря этому взаимодействию происходит подавление фетальной генной программы. Пол пациентов влияет на тяжесть клинических симптомов КМП, что указывает на присутствие дополнительных механизмов развития этого патологического процесса.
Диагностика ДКМП
В оценке гемодинамики и прогноза больных ДКМП физикальное обследование часто не имеет большой ценности. Именно поэтому плазменные биологические маркеры и такие диагностические исследования, как ЭхоКГ, ЭКГ (корригированный интервал Q-T) или тест с физической нагрузкой часто используют для того, чтобы получить дополнительную объективную информацию.
Нейрогормоны
Мозговой натрийуретический пептид, выделяющийся в ответ на растяжение кардиомиоцита [83], в настоящее время считают общепризнанным маркером, позволяющим определить дальнейшую тактику лечения больного. Двукратное по сравнению с нормой повышение его концентрации в плазме крови - предиктор неблагоприятного прогноза у пациентов с ХСН.
Другой предиктор высокой сердечно-сосудистой летальности при стабильной тяжелой ХСН, коррелирующий с тяжестью клинических симптомов заболевания, - концентрация интерлейкина-6 в крови. Содержание норадреналина в плазме крови также считают предиктором сердечно-сосудистой заболеваемости и смертности.
ЭКГ
Изменения на ЭКГ при ДКМП достаточно неспе-цифичны. Тем не менее возникновение ФП - прогностически неблагоприятный признак, ассоциированый с повышением летальности, а также прогрессированием СН при любых типах КМП. Снижение ВСР вследствие постоянной чрезмерной симпатической стимуляции также связано с неблагоприятным прогнозом, а удлиненный интервал Q-T считают предиктором смерти. Кроме того, желудочковые нарушения ритма и снижение ВСР по данным ХМ в сочетании с низкой ФВ ЛЖ позволяют отнести больных ДКМП к группе пациентов с высоким риском смерти. БЛНПГ с продолжительностью комплекса QRS 130-150 мс может быть признаком асинхронии ЛЖ, рассматриваемым в качестве критерия отбора пациентов для РСТ.
ЭхоКГ
2D-ЭхоКГ с допплерографическим анализом - важнейший метод диагностики ДКМП. При этом важными параметрами оценки ремоделирования левого ЛЖ считают не только его размер (КДР ЛЖ) и форму (соотношение длинной и короткой осей ЛЖ). Один из наиболее широко используемых параметров определения функции ЛЖ - ФВ ЛЖ, на основании которой КМП классифицируют по степени тяжести на тяжелую (ФВ ЛЖ ≤30%), умеренную (ФВ ЛЖ 30-45%) и нетяжелую (ФВ ЛЖ ≥45%). Кроме того, по результатам допплерографического исследования можно определить тяжесть митральной регургитации и предсказать развитие и выраженность симптомов СН. Ранее было доказано, что у пациентов с ДКМП ФВ ЛЖ ‹30%, КДД в ЛЖ ≥15 мм рт.ст, а также признаки начальной или прогрессирующей митральной регургитации ассоциированы с неблагоприятным прогнозом. Показатель летальности в этой группе пациентов составляет 15-20%, тогда как в группе больных с умеренной тяжестью заболевания (ФВ ЛЖ ≥45% и КДД в ЛЖ менее 15 мм рт.ст.) ежегодная смертность колеблется от 5 до 8%. Высокое давление в предсердиях при рестриктивном типе диастолической функции ЛЖ также ассоциировано с более высокой летальностью. В случае псевдонормального диастолического наполнения ЛЖ или нарушения его релаксации выживаемость больных с ДКМП значительно выше. Существование стойких нарушений диастолического наполнения и расслабления на фоне проведения оптимального лечения в течение 3 мес ассоциировано с высокой летальностью. Митральная недостаточность при ДКМП ухудшает прогноз, но ее хирургическое лечение (аннулопластика в сочетании с пластикой МК) улучшает прогноз заболевания. Именно поэтому у пациентов с ДКМП большое значение для оценки степени тяжести митральной недостаточности имеет своевременное выполнение трансэзофагеальной ЭхоКГ.
Кардиопульмональная нагрузочная проба
Проба характеризует способность сердечной мышцы отвечать на физическую нагрузку, определяет степень полноценности сердечного ответа и служит установленным предиктором риска при ДКМП. Кроме того, сочетание таких показателей, как VO2 анаэробного порога (менее 11 мл/кг в 1 мин) и эффективность вентиляции (кривая VE против V CO2) более 34, считают надежным предиктором летальности больных в течение 6 мес. По данным кардиопульмональной пробы, пациенты с ишемической и ДКМП не различаются по прогнозу, несмотря на имеющуюся разницу в нейрогуморальном профиле.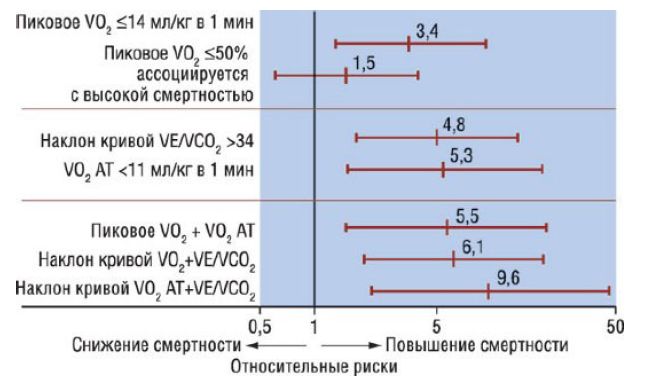
Кардиопульмональная нагрузочная проба: предикторы летального исхода (относительный риск, доверительный интервал 95%) в течение 6 мес у пациентов с дилатационной кардиомиопатией и кардиомиопатией ишемической этиологии.
МРТ
МРТ сердца стала новым стандартом оценки объемов желудочков, ФВ, массы миокарда и региональной сократимости. С помощью парамагнетика можно обнаружить нарушение регионального сокращения миокарда и области нежизнеспособного миокарда, для которых характерно позднее заполнение контрастным веществом. Этот метод отличается более высокой чувствительностью по сравнению со сцинтиграфией с таллием.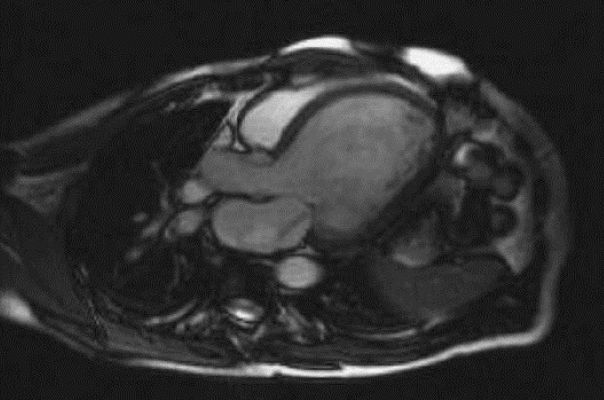
Магнитно-резонансная томография пациента с дилатационной кардиомиопатией: горизонтальное сечение дилатированного ЛЖ со струей митральной регургитации вследствие митральной недостаточности.
Катетеризация правых и левых отделов сердца
Коронарография - необходимая диагностическая процедура при установлении диагноза ДКМП, позволяющая исключить атеросклеротический процесс в венечных артериях. В процессе этого исследования можно получить важную дополнительную информацию о состоянии сердечного выброса, напряжении стенок миокарда, а также характеристиках ЛА (расширение, растяжимость и давление). Такие параметры, как давление заклинивания или величина легочного сосудистого сопротивления можно использовать в дальнейшем для стратификации риска. Катетеризация камер сердца - диагностическая процедура, но ее не выполняют, если пациент уже получает лечение по поводу ДКМП.
Эндомиокардиальная биопсия
Чаще всего гистологическая картина образцов, полученных при эндомиокардиальной биопсии, неспецифична: обнаруживают гипертрофию кардиомиоцитов, увеличение размеров ядер и интерстициальный фиброз. У большинства асимптомных родственников больных ДКМП, имеющих увеличение размеров ЛЖ, находят гистологические и иммунологические изменения, сходные с таковыми у больных ДКМП. Кроме того, гибридизация in situ позволяет обнаружить персистирующий вирус в эндомиокардиальных биоптатах и поставить диагноз хронического миокардита даже в тех случаях, когда при гистологическом исследовании отсутствует лимфоцитарная инфильтрация.
Лечение ДКМП
Независимо от этиологии заболевания и использования специфических методов лечения (т.е. противовоспалительной, противовирусной и иммуномодулирующей терапии), все общие принципы лечения СН в равной степени применимы и к ДКМП, т.е. применяют иАПФ, БРА, β-адреноблокаторы, диуретики, антагонисты альдостероновых рецепторов, сердечные гликозиды и трансплантацию сердца. Назначают следующие группы препаратов.
• Ингибиторы АПФ или антагонисты рецепторов к ангиотензину I.
• Дозы β-адреноблокаторов (карведилол, метопролол, бисопролол, небиволол) титруют доз в соответствии с принципом "тише едешь, дальше будешь".
• Антагонисты альдостероновых рецепторов способствуют повышению риска развития гиперкалиемии на фоне лечения иАПФ или рецепторов к ангиотензину II.
Необходимо полностью прекратить прием потенциально кардиотоксичных веществ (например, этилового спирта, антрациклинов). Кроме того, физические тренировки могут способствовать уменьшению симптомов СН и улучшению прогноза. При ДКМП в качестве дополнительного метода лечения можно применять РСТ, если существует БЛНПГ, а продолжительность комплекса QRS превышает 120 мс на фоне СН III-IV функционального класса по NYHA.
Трансплантация сердца до сих пор остается радикальным методом лечения пациентов, страдающих ДКМП с терминальной стадией СН, рефрактерной к проводимой терапии. Искусственный ЛЖ может поддержать его функцию до проведения трансплантации ("мост к трансплантации") или до тех пор, пока не произойдет устойчивое улучшение его функции ("мост к выздоровлению"). Возможности частичной вентрикулэктомии (пластики ЛЖ) как метода лечения ДКМП достаточно ограничены.
Оценка риска и первичная профилактика внезапной сердечной смерти при ДКМП - трудная задача. Программированная стимуляция желудочков у больных ДКМП не имеет такой прогностической ценности, как при ИБС. ВСС в семейном анамнезе - показание для установки ИКД (вторичная профилактика). Также серьезным предиктором ВСС при ДКМП считают обмороки . Больных ДКМП можно отнести к группе высокого риска ВСС, если у них обнаружена неустойчивая ЖТ, подтвержденная данными ХМ, КДР ЛЖ >70 мм или ФВ ЛЖ ‹30%. Общепринятое лечение СН также способствует уменьшению летальности, благодаря профилактике ВСС. В качестве метода первичной профилактики ВСС установка ИКД имеет преимущества по сравнению с применением амиодарона. По результатам клинического исследования АMIOVIRT (Сравнение амиодарона и ИКД у пациентов с КМП неишемической этиологии и асимптомными неустойчивыми ЖТ), не было получено достоверных различий между приемом амиодарона и установкой ИКД. В исследованиях COMPANION (Сравнение медикаментозного лечения, электрокардиостимуляции и дефибрилляции при СН) и SCD-Heft (Исследование ВСС при ХСН) подтверждено преимущество установки ИКД для вторичной профилактики ВСС.
При ФП у больных ДКМП следует достигать контроля ритма и (или) оптимальной ЧСС.
Больным ДКМП при ФП рекомендована антикоагулянтная терапия. При тромбэмболических осложнениях в анамнезе, а также при выраженном нарушении функции ЛЖ ее также назначают. В настоящее время нет достаточных данных, свидетельствующих о пользе антикоагулянтной терапии у пациентов с ДКМП с синусовым ритмом (исследование WATCH).
Пациентам с семейной формой ДКМП и их родственникам первой степени родства следует рекомендовать генетическое консультирование. Учитывая то, что у многих из членов семей больных ДКМП существует асимптомное увеличение размеров ЛЖ, их также необходимо обследовать (ЭКГ и ЭхоКГ).
Прогноз и исход
Пятилетняя выживаемость больных ДКМП колеблется от 30 до 36%. После установления диагноза ДКМП течение заболевания может широко варьировать. Обнаружение модифицируемых факторов риска и разработка эффективных мероприятий, направленных на их профилактику, чрезвычайно важно для прогноза больных ДКМП. Исследовательской группой по изучению болезней миокарда были проведены подробные проспективные исследования, по результатам которых пациентов разделили на две подгруппы. К первой подгруппе отнесли больных с быстропрогрессирующим течением заболевания и высоким риском смерти, нуждающихся в инотропной поддержке и (или) установке аппарата вспомогательного кровообращения и ургентной трансплантации сердца. Пациенты второй подгруппы хорошо отвечали на проводимое лечение СН (около 50% больных) и имели более благоприятный прогноз. В 16% случаев зарегистрировано полное излечение, чаще всего - после остро развившейся ДКМП в рамках фульминантного миокардита. Выживаемость пациентов с ДКМП без трансплантации сердца, а также снижение риска ВСС в значительной степени ассоциированы с течением ХСН (т.е. с ее функциональным классом по NYHA) и улучшением функции ЛЖ под влиянием оптимального лечения ХСН.
Данные последних исследований подтверждают снижение смертности и числа госпитализаций больных ДКМП, получающих оптимальное лечение СН, но оно не направлено на устранение причины заболевания и у части пациентов не приносит эффекта. Воспаление и персистенция кардиотропных вирусов (вирусная репликация) - патогенетический субстрат, связанный с неблагоприятным исходом заболевания. Стандартное гистологическое исследование биоптатов не имеет большой прогностической ценности. Обнаружение мутации генов, ассоциированных с неблагоприятным прогнозом при ДКМП, также имеет самостоятельное значение в качестве прогностического фактора.


