В США более 400 000 ежегодных смертельных исходов классифицированы как внезапные и вероятнее всего вызваны аритмиями. Наиболее жизнеугрожающей является желудочковая тахикардия. У пациентов с желудочковыми аритмиями вследствие коронарной патологии использование имплантируемых кардиовертеров-дефибрилляторов (ИКД) для предотвращения внезапной смерти оказалось достаточно эффективным.
Другими проблемами у этой категории больных являются наличие сохраняющейся ишемии и прогрессирующая сердечная недостаточность, связанная с дилатацией и снижением сократительной функции левого желудочка и митральной недостаточностью. Имплантация кардиовертера-дефибриллятора не предотвращает эпизоды аритмии, ишемии или прогрессирование сердечной недостаточности. Хирургическое лечение, направленное на ликвидацию структурных нарушений сердца в максимально возможной степени, может не только предотвратить повторение аритмии, но также улучшить качество жизни и выживаемость пациентов.
Клинические исследования Cardiac Arrest Study Hamburg (CASH), Antiarrhythmics Versus Implantable Defibrillators (AVID), Multicenter Unsustained Tachycardia Trial (MUSTT), Canadian Implantable Defibrillator Study (CIDS) и Multicenter Automatic Defibrillator Implantation Trial (MADIT) доказали преимущества использования имплантируемых кардиовертеров-дефибрилляторов перед медикаментозным лечением и только исследование CABG Patch Trial, сравнивающее результаты АКШ и АКШ с ИКД, не выявило преимуществ использования последнего.
Физиология желудочковых тахикардий
После инфаркта миокарда образуется соединительнотканный рубец, где скорость передачи электрического сигнала замедляется и создается возможность возникновения круга re-entry, который может быть прерван антиаритмическими препаратами, катетерной или хирургическими аблацией. Другие формы желудочковой тахикардии и фибрилляции желудочков обусловлены нарушением автоматизма вследствие ишемии миокарда, увеличением напряжения стенки левого желудочка и миопатическим повреждением кардиомиоцитов. Применение антиаритмических препаратов I класса после инфаркта миокарда способно увеличить смертность вследствие проаритмических эффектов.
У больных ИБС с относительно хорошей желудочковой функцией и желудочковыми аритмиями, которые провоцируются физической нагрузкой при доказанной в этот момент ишемией, одна только реваскуляризация миокарда, устраняя ишемию как возможный пусковой механизм желудочковой тахикардии, улучшает прогноз. Проведенное после АКШ электрофизиологическое обследование позволяет выявить больных, которым все же будет необходима имплантация ИКД.
Другим подходом в лечении желудочковой тахикардии является проведение транспредсердной картографии на интактном сердце, позволяющей получить более полную картину нарушений ритма в пределах относительно короткого промежутка времени. Для этого используется баллон с большим количеством электродов, который вводится через небольшой разрез левого предсердия и митральный клапан в левый желудочек и наполняется до достижения хорошего контакта электродов с эндокардом. Давление в баллоне контролируется для предотвращения субэндокардиальной ишемии.
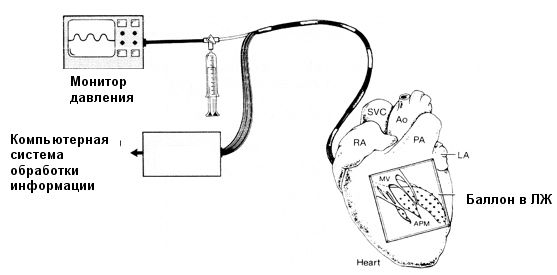
Эндокардиальное картирование левого желудочка
Полученная информация представляется как ряд изосинхронных карт с цветной маркировкой в реальном режиме времени. Электростимуляция в определенных точках эндокарда левого желудочка позволяет выявить не только участок, ответственный за индукцию желудочковой тахикардии, но и область, где возникает круг re-entry. На картограммах она представлена в заштрихованном виде. Этот участок подлежит аблации. 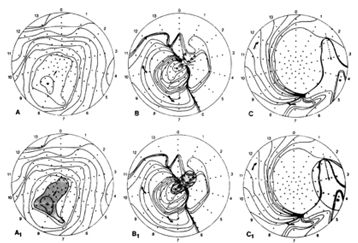
Результаты эндокардиального картирования левого желудочка
Результаты картографических исследований показывают, что область, ответственная за развитие желудочковой тахикардии, обычно располагается в пограничной зоне между жизнеспособным миокардом и постинфарктным рубцом и соответствует наличию живых волокон миокарда в фиброзной ткани. У большинства пациентов ИБС со сниженной функцией левого желудочка и желудочковыми аритмиями аритмогенный очаг располагается в межжелудочковой перегородке в области акинеза или дискинеза миокарда в зоне верхушки сердца.
Поскольку картография - трудоемкий процесс, требующий специализированного оборудования, во многих центрах используется визуальный подход к удалению очагов желудочковой тахикардии. Он заключается в резекции рубца (аневризмы) с последующей реконструкцией полости левого желудочка. Локализация рубца миокарда в межжелудочковой перегородке вблизи задней папиллярной мышцы может ограничить объем резекции, а его расширение с последующим протезированием митрального клапана снижает выживаемость пациентов в отдаленном послеоперационном периоде.
Различные альтернативные методы ликвидации очагов желудочковой тахикардии основаны на разрушении ткани в пограничной зоне между рубцом и жизнеспособным миокардом также имеют потенциальные отрицательные эффекты на структуру и функцию левого желудочка. К таким методам относятся:
- резекция эндокарда (удаление видимого внутрисердечного рубца);
- криоаблация. Глубина повреждения ткани, достигнутой при криоаблации зависит от температуры и экспозиции. Использование 15 мм зонда, охлажденного до -60° C с экспозицией 2 мин. приводило к деструкции ткани на 2 мм в глубину при нормотермической перфузии и до 6 мм - при холодовой кардиоплегии;
- лазерная фотоаблация;
- радиочастотная аблация.
Чем более радикально выполнена процедура, тем менее вероятен рецидив желудочковой тахикардии. Вместе с тем дополнительное повреждение может иметь отрицательный эффект на функцию левого желудочка или митрального клапана.
Важной частью хирургического подхода у пациентов с ИБС, желудочковыми аритмиями и сниженной функцией левого желудочка в дополнение к аблации аритмогенных очагов и реваскуляризации миокарда является ремоделирование левого желудочка и восстановление компетентности митрального клапана. После ликвидации аритмогенных участков обязательно должна быть выполнена реконструкция левого желудочка с восстановлением его нормальных размеров и геометрии с использованием описанных ранее методов. Митральная реконструкция с применением различных видов пластики, как правило, устраняет недостаточность клапана. Потенциальные преимущества такого подхода заключаются в снижении напряжения стенки левого желудочка и уменьшении потребления кислорода миокардом. Изменение ориентации волокон миокарда приводит к увеличению его сократительной способности. Механическая разгрузка с уменьшением дилатации противоположной стенки левого желудочка также может предотвращать аритмии.
Результаты хирургического лечения
Пациенты с желудочковой тахикардией относятся к группе больных с высоким риском. Средняя фракция выброса левого желудочка оперируемых больных составляет 25-30%. Госпитальная летальность при выполнении комплексной реконструкции, включающей аблацию аритмогенных очагов, колеблется в диапазоне от 2% до 10%. Факторы риска неблагоприятных исходов включают пожилой возраст, низкую фракцию изгнания, выраженную сердечную недостаточность и нижний инфаркт миокарда в анамнезе. Рецидив аритмии отмечен у 10-20% больных, свобода от внезапной смерти в течение 5-летнего периода наблюдения составила 90%, выживаемость – 70-80%. Пациенты с рецидивом желудочковых тахикардий нуждаются в лечении амиодароном или имплантации ИКД.
Катетерная аблация ликвидирует желудочковую тахикардию у 82% больных. Непосредственная летальность - 1,8 %, но у 8% пациентов развиваются осложнения, включая шок, острую ишемию миокарда или тампонаду перикарда. 5-летняя выживаемость составляет 49%, а рецидивы желудочковой тахикардии отмечены у 72% пациентов. Из приведенных данных видно, что результаты катетерной аблации значительно уступают результатам комплексного хирургического лечения.
Многочисленные рандомизированные исследования, сравнивающие результаты имплантации кардиовертера-дефибриллятора и комплексной хирургической реконструкции у пациентов с желудочковыми аритмиями и сниженной фракцией выброса, показали, что 5-летняя выживаемость в группе больных с ИКД составила 60%, что также значительно ниже, чем в хирургической группе.
Таким образом, у пациентов ИБС с низкой фракцией выброса и желудочковыми тахиаритмиями рекомендуется комплексный хирургический подход с полной реваскуляризацией миокарда, ремоделированием левого желудочка и пластикой митрального клапана в сочетании с хирургической аблацией аритмогенных очагов. Во время выполнения хирургического вмешательства перегородка должна быть исследована на наличие рубца. Последний необходимо резецировать с проведением криоаблации по периферии линии резекции. В послеоперационном периоде рекомендуется электрофизиологическое исследование и в случаях возникновения желудочковой тахикардии при проведении провокационной пробы показано использование амиодарона или имплантация кардиовертера-дефибриллятора.
Имплантируемый кардиовертер-дефибриллятор
За последние годы произошел серьезный технологический прогресс в конструкции ИКД: срок службы аккумулятора был увеличен более 5 лет, размер и вес уменьшены до величины ЭКС, электроды из эпикардиальных, требующих торакотомии, стали эндокардиальными с возможностью двухфазного разряда. Появилась возможность программирования функций, присущих ЭКС – сохранение ЭКГ, VVI, DDD и антитахикардитическая функции и т.д. Это позволило значительно снизить травматичность операции и улучшить отдаленные результаты. Терапевтическая эффективность ИКД хорошо доказана, однако ИКД дорог ($6 000-12 000), требует изменения образа жизни и вызывает дискомфорт, поэтому целесообразность его профилактической имплантации спорна.
Показания
Имплантация кардиовертера-дефибриллятора показана больным, перенесшим зарегистрированную остановку сердца в отсутствии острого инфаркта миокарда и больным с неэффективностью антиаритмических препаратов или не подлежащих хирургической аблации по результатам электрофизиологических исследований. Вместе с тем, у многих пациентов, перенесших остановку сердца, после провокационной стимуляции не развивается желудочковая тахикардия, у других больных с синкопе в анамнезе – развивается провоцируемая желудочковая тахикардия, но нет клинических проявлений аритмии. В этой связи после проведения исследований MADIT и MADIT II показания к имплантации ИКД были расширены. В качестве показаний дополнительно предложены провоцируемая желудочковая тахикардия, короткие периоды желудочковой тахикардии или низкая сократительная способность миокарда (ФВ < 30%) у больных с инфарктом миокарда в анамнезе.
Имплантируемый кардиовертер-дефибриллятор
В ИКД используются две системы электродов: одна для восприятия желудочкового сигнала или его стимуляции, другая – с целью доставки энергии дефибрилляции. Эти системы обычно биполярны, но в некоторых ИКД используется однополярный желудочковый электрод. Все применяемые электроды имеют активную фиксацию. Программный алгоритм позволяет различать наджелудочковые аритмии от желудочковой тахикардии. Для этого дополнительно используются биполярный предсердный электрод, который при необходимости обеспечивает предсердную стимуляцию. У пациентов с высоким порогом дефибрилляции дополнительно используется подкожный электрод. 
Имплантируемый кардивертер-дефибриллятор с электродами
Имплантируемый кардивертер-дефибриллятор содержит высокоэнергетическую батарею и конденсатор для усиления выходного напряжения до 600-800 Вт (35-40 Дж). Двухфазный (положительные и отрицательные фазы) разряд повышает эффективность дефибрилляции. Устройство включает интегральные схемы и антенну телеметрии и поддерживает широкий диапазон программируемых диагностических и терапевтических функций.
Большинство пациентов, нуждающихся в имплантации ИКД, имеют высокий риск операции. Предоперационная подготовка направлена на профилактику ишемии миокарда, лечение сердечной недостаточности и сопутствующих заболеваний. Поскольку ишемия миокарда имеет более высокий риск, чем фракция изгнания ниже 15%, имплантация ИКД иногда выполняется на фоне ЧТКА и контрпульсации.
Техника операции не отличается от имплантации ЭКС. Самая трудная часть операции имплантации ИКД для пациента – возникновение и купирование желудочковой тахикардии. В случаях, когда для этого требуется многократные разряды дефибриллятора, применяется эндотрахеальный наркоз. Для профилактики повреждения системы из-за образования дуги при внешней дефибрилляции накожные электроды для дефибрилляции не должны располагаться в непосредственной близости от ИКД.
Разрезом 6 см в подключичной области в s.deltopectoralis обнажается v.cephalica. Электроды проводятся через интродьюсер в верхушку правого желудочка и правое предсердие и фиксируются. Эти манипуляции могут провоцировать фибрилляцию желудочков. Проводятся стандартные пробы порога дефибрилляции электрокардиостимуляции и величины внутрисердечного потенциала. В это время проводится постоянная флюороскопия для контроля возможного смещения электрода, особенно если в этот момент необходима внешняя дефибрилляция.
Измерение порога дефибрилляции требует индукции желудочковой тахикардии. Порог должен быть, по крайней мере, на 10 Дж меньше, чем максимальная мощность ИКД. Если порог дефибрилляции при оптимальном расположении внутрисердечных электродов выше этого уровня, требуется использование дополнительного подкожного электрода для лучшего распределения потока энергии по боковым стенкам левого желудочка. Измерение порога дефибрилляции может провоцировать снижение сердечного выброса.
Левосторонний пневмоторакс, который может возникнуть вследствие технических ошибок пункции подключичной вены, является сильным изолятором, значительно увеличивает порог дефибрилляции и может быть причиной неэффективной кардиоверсии. Это необходимо учитывать, так как другими причинами высокого порога дефибрилляции являются ишемия миокарда, электромеханическая диссоциация, плохое распределение разряда. Неспособность восстановить ритм - критическое положение во время операции, которое может потребовать открытого массажа сердца или искусственного кровообращения, пока решение не будет найдено.
Имплантируемый кардивертер-дефибриллятор помещается в подкожный карман в области большой грудной мышцы. Если необходимо его размещение в верхнем левом квадранте брюшной полости под прямой мышцей живота, в подкожной клетчатке по передней поверхности грудной клетки формируется туннель для проведения электродов. Последние надежно фиксируются в месте выхода из вены для предотвращения их дислокации. Профилактика инфекции во время операции достигается внутривенным ведением ванкомицина или гентамицина. Антибиотикопрофилактика продолжается в течение 7 суток пероральным приемом цефалоспоринов.
Для подтверждения стабильности работы ИКД через 7-14 дней после выписки из стационара может понадобится повторное исследование порога дефибрилляции и программация. Персонал должен знать, как использовать магнит, чтобы запретить разряды ИКД, которые возникают при дислокации электрода в правый желудочек или суправентрикулярной аритмии. Контрольные осмотры с тестированием заряда генератора контроля работы конденсатора, сенсорных и стимулирующих функций ИКД проводится с 1-3 месячными интервалами.
Результаты
Госпитальная летальность после имплантации ИКД составляет 1%. Осложнения включают инфаркт миокарда, остановку сердца, дислокацию электрода, инфекцию, и нарушения венозного оттока.
В послеоперационном периоде пациентов беспокоит дискомфорт и дистресс из-за разрядов дефибриллятора. В то время как многие больные полностью удовлетворены возможностью спасения от злокачественной аритмии, другие пребывают в постоянном беспокойстве из-за постоянного стресса.
Срок службы аккумулятора ИКД - более 60 месяцев. Замена проводится под местной анестезией с седацией во время измерения порога дефибрилляции.
Нарушение функции электродов прогрессирует с продолжительностью срока работы ИКД. У 50% пациентов требуется замена электродов в течение 10-летнего периода наблюдения. Причинами нарушения функции электродов являются перелом электрода, высокий порог дефибрилляции, нарушение детекторной функции и exit block. Увеличение порога дефибрилляции может быть следствием дилатации сердца, которое перемещает левый желудочек влево, далеко от электрода. В течение 2-летнего периода наблюдения частота развития дислокации желудочкового электрода составляет 7%, перелома электрода - 6 %. Как правило, развитие указанных осложнений диктует замену электродов.
Лечение желудочковой тахикардии с использованием ИКД достаточно дорого, но стоимость медикаментозной терапии также существенна. Необходимо значительное снижение стоимости генераторов ИКД прежде, чем этот способ лечения найдет широкое применение.
Проф. д.м.н. Островский Ю.П.


